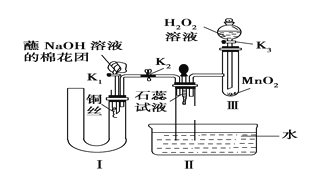
-
化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质
实际应用
A
铁常温下遇浓硫酸钝化
用铁桶装浓硫酸
B
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C
次氯酸盐溶液与CO2反应
漂白粉漂白织物
D
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
你认为减少酸雨产生的途径可采取的措施是( )
①减少煤作燃料 ②造高工厂烟囱 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A. ①②③ B. ②③④⑤ C. ①③⑤ D. ①③④⑤
难度: 简单查看答案及解析
-
硅是在人类文明发展过程中起了重要作用的元素。下列有关硅的说法正确的是( )
A. 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
B. 硅在自然界中有单质存在
C. 光纤通信是以光作为信息的载体,光导纤维的主要成分是SiO2
D. 硅单质的性质十分稳定,不能和任何物质发生反应
难度: 简单查看答案及解析
-
科学家将铅和氪两种元素的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数与核外电子数之差是( )
A. 47 B. 57 C. 61 D. 293
难度: 简单查看答案及解析
-
下列化学用语表示不正确的是( )
A. 氮化镁:MgN
B. Ca(OH)2的电离方程式:Ca(OH)2=Ca2++2OH‑
C. 中子数为18的氯原子:
D. 氟化钠的电子式为:
难度: 简单查看答案及解析
-
硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是( )
A. 青花瓷 B. 金刚石 C. 光导纤维 D. 大理石
难度: 简单查看答案及解析
-
有关元素周期表的说法中错误的是( )
A. 元素周期表中第16个纵行为ⅥA族
B. ⅦA族元素也称为卤族元素
C. 元素周期表中,Ⅷ族包括第8,9,10三个纵行
D. 0族元素的原子最外层电子数均为8,元素化合价为0
难度: 中等查看答案及解析
-
下列物质反应后一定没有+3价铁生成的是( )
A. 过量的Fe与Cl2加热时发生反应
B. Fe与过量稀盐酸反应
C. FeCl2溶液中加少量硝酸
D. Fe和Fe2O3的混合物溶于盐酸中
难度: 中等查看答案及解析
-
下列各组气体在常温下都不能共存,其中极易发生非氧化还原反应而不能共存的是( )
A. H2S和SO2 B. NO和O2 C. NH3和HCl D. Cl2和H2S
难度: 中等查看答案及解析
-
5 mL物质的量浓度为18 mol·L-1的硫酸中加入足量铜片并加热,充分反应。下列说法正确的是( )
A. 有0.09 mol的硫酸被还原 B. 有0.045 mol的硫酸被还原
C. 充分反应后体系无硫酸剩余 D. 消耗的铜的质量一定小于2.88 g
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是( )
A. 硫酸镁与氯化钡溶液的反应:MgSO4+Ba2+=Mg2++ BaSO4↓
B. 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C. 向水玻璃中滴加盐酸:Na2SiO3 + 2H+=H2SiO3 ↓+ 2Na+
D. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
难度: 中等查看答案及解析
-
下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A. 在空气中敞口久置的浓硫酸,溶液质量增大难挥发性
B. 在加热条件下铜与浓硫酸反应强氧化性、酸性
C. 蔗糖与浓硫酸反应中有海绵状的炭生成吸水性
D. 浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色脱水性
难度: 中等查看答案及解析
-
下列有关SO2的性质的探究实验报告记录的实验现象正确的是( )
实验

记录
A
无色
无色
无现象
无色溶液
B
红色
无色
白色沉淀
白色溶液
C
无色
无色
白色沉淀
无色溶液
D
红色
红色
白色沉淀
白色溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是( )
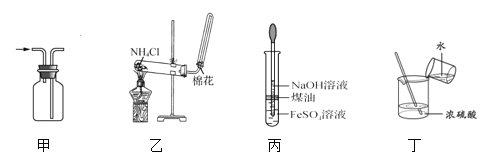
A. 用图甲所示装置收集NO B. 用图乙所示装置制备NH3
C. 用图丙所示装置制备Fe(OH)2 D. 用图丁所示装置稀释浓H2SO4
难度: 中等查看答案及解析
-
铝热反应可用于焊接钢轨,反应为:2Al + Fe2O3
2Fe + Al2O3,下列关于该反应说法正确的是( )
A. Al 是还原剂 B. Fe2O3 发生氧化反应
C. Fe 是氧化产物 D. 当生成 1 mol Fe 时,转移 6 mol 电子
难度: 中等查看答案及解析
-
下列有关物质性质的比较正确的是( )
①同主族元素的单质从上到下,氧化性逐渐增强
②元素的非金属性越强,气态氢化物的热稳定性越弱
③单质与水反应的剧烈程度:K>Na>Li
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤酸性:HNO3>H3PO4
A. ①③ B. ②④ C. ③⑤ D. ②⑤
难度: 中等查看答案及解析
-
将装有60mLNO2、NO混合气体的量筒倒立于水槽中,反应后气体体积缩小为40mL,则混合气体中NO2和NO的体积比是( )
A. 5:3 B. 2:3 C. 1:1 D. 2:1
难度: 困难查看答案及解析
-
短周期元素的W为Mg,X为Na,Y为O,Z为F,则下列说法正确的是( )
A. 原子半径:W>X>Z>Y B. 热稳定性: H2Y>HZ
C. 离子半径:W2+>Y2- D. 碱性:XOH>W(OH)2
难度: 中等查看答案及解析
-
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
A. 原子半径由小到大的顺序:X< Y < Z< W
B. Z的最高价氧化物能与水反应生成相应的酸
C. Y单质在一定条件下可以与氧化铁发生置换反应
D. XW4是离子化合物
难度: 中等查看答案及解析
-
向2.0 L 浓度均为1.0 mol·L−1 的 CuSO4、Fe2(SO4)3 和 H2SO4 的混合液中加入足量的铁粉,反应停止后,铁粉有剩余,此时溶液中 Fe2+ 的物质的量浓度是(溶液的体积变化忽略不计)( )
A. 1.5 mol·L−1 B. 2.0 mol·L−1 C. 3.0 mol·L−1 D. 5.0 mol·L−1
难度: 中等查看答案及解析