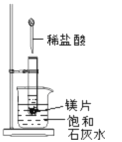
-
下列反应中,即属于氧化还原反应同时又是吸热反应的是( )
A. Ba(OH)2.8H2O与NH4Cl反应 B. 铝与稀盐酸
C. 灼热的炭与CO2反应 D. 甲烷与O2的燃烧反应
难度: 简单查看答案及解析
-
已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6kJ·mol-1,则下列关于方程式2H2O(l)===2H2(g)+O2(g)的ΔH的说法中正确的是( )
A. 方程式中的化学计量数表示分子数
B. 该反应ΔH大于零
C. 该反应ΔH=-571.6kJ·mol-1
D. 该反应可表示36g水分解时的热效应
难度: 简单查看答案及解析
-
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是 ( )
A. 0.1 mol·L-1Ca(NO3)2溶液中:Na+、NH4+、CO32-、CH3COO-
B. 能使甲基橙变红的溶液中:K+、Na+、NO3-、Cl-
C. 3%H2O2溶液中:Fe2+、H+、SO42-、Cl-
D. 0.1 mol·L-1KSCN溶液中:Fe3+、NH4+、Br-、SO42-
难度: 中等查看答案及解析
-
X、Y、Z、W四块金属板分别用导线两两相连浸入稀硫酸中构成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断四种金属的活动性顺序是( )
A. X>Z>W>Y B. Z>X>Y>W
C. X>Y>Z>W D. Y>W>Z>X
难度: 中等查看答案及解析
-
如下图所示装置中,属于电解池的是 ( )
A.
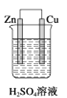
B.
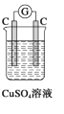
C.
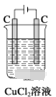
D.
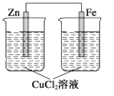
难度: 简单查看答案及解析
-
用石墨作电极电解CuCl2和KCl的混合溶液,电解初期阴极和阳极分别析出的物质是( )
A. H2、Cl2 B. Cu、Cl2
C. H2、O2 D. Cu、O2
难度: 中等查看答案及解析
-
在N2+3H2
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol·L-1,在此段时间内用H2表示的平均反应速率为0.45mol·L-1·s-1,则此段时间是 ( )
A. 1s B. 2s
C. 44s D. 1.33s
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol·L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA
B. 标准状况下,11.2 L CCl4中含有的分子数目为0.5NA
C. 28 g聚乙烯中含有的碳原子数目为2NA
D. 1 mol CH5+中含有的电子数目为11NA
难度: 中等查看答案及解析
-
下列有关化学用语表示不正确的是( )
A. 氯离子的结构示意图:
B. 乙醇分子式:C2H6O
C. 乙烯的结构式:CH2=CH2 D. 苯分子的比例模型:

难度: 简单查看答案及解析
-
在不同条件下,分别测得反应2SO2+O2
2SO3的化学反应速率,其中表示该反应进行得最快的是 ( )
A. v(SO2)=4mol·L-1·min-1 B. v(O2)=3mol·L-1·min-1
C. v(SO3)=0.1mol·L-1·s-1 D. v(O2)=0.1mol·L-1·s-1
难度: 中等查看答案及解析
-
有机物丁香油酚的结构简式为:
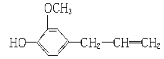 。按官能团分类,它不属于( )
。按官能团分类,它不属于( )A. 烯类 B. 酚类
C. 醚类 D. 醇类
难度: 中等查看答案及解析
-
已知反应X+Y=M+N为放热反应,对该反应的说法正确的是( )
A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因为该反应为放热反应,所以一定不必加热就可以发生
难度: 简单查看答案及解析
-
人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e=ZnO+H2↑,Ag2O+H2O+2e==2Ag+2OH-。据此判断氧化银是 ( )
A. 负极,并被氧化 B. 正极,并被还原
C. 负极,并被还原 D. 正极,并被氧化
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 将铜丝插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+H2O
B. 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+ =H2SiO3↓+2Na+
难度: 中等查看答案及解析
-
下列过程与蛋白质变性无关的是( )
A. 用煮沸的方法可使医疗器械消毒
B. 用福尔马林保存生物标本
C. 鸡蛋白溶液里加入饱和硫酸铵溶液,可以观察到有沉淀析出
D. 鸡蛋白溶液里加入少量乙酸铅溶液,可以观察到有沉淀生成
难度: 中等查看答案及解析
-
L—多巴是一种有机物,可用于帕金森综合症的治疗,其结构简式如下:
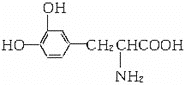
下列关于L—多巴的叙述中不正确的是( )
A. 长期暴露在空气中易变质
B. 既有酸性,又有碱性
C. 一定条件下能发生聚合反应
D. 分子中只有6个碳原子共平面
难度: 中等查看答案及解析
-
已知CH4(g)+2O2(g)=2CO2(g)+2H2O(l);△H=-Q1,2H2(g)+O2(g)=2H2O(g) ;△H=-Q2,2H2(g)+O2(g)=2H2O(l) ;△H=-Q3,常温下取体积比为4:1的CH4和H2的混合气11.2L(标况)经完全燃烧后恢复至常温,放出的热量是 ( )
A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2
C. 0.4Q1+0.1Q3 D. 0.4Q1+0.2Q2
难度: 中等查看答案及解析
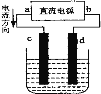

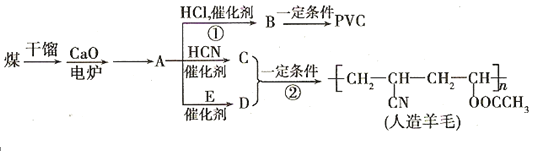 请回答下列问题:
请回答下列问题: