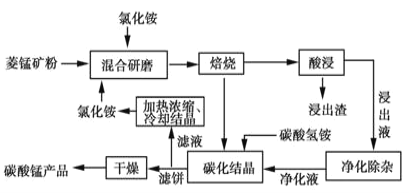
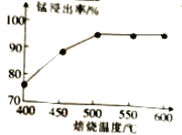
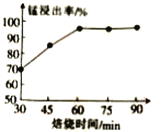
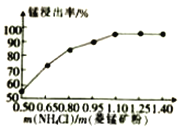
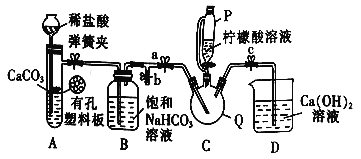
-
已知
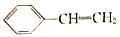 (X)、
(X)、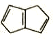 (Y)互为同分异构体,下列说法不正确的是
(Y)互为同分异构体,下列说法不正确的是A. Y的一氯代物只有三种
B. X的所有原子可能处于同一平面
C. X、Y与足量氢气完全加成时所需氢气的物质的量之比为1:1
D. X、Y均可使溴的水溶液褪色,且褪色的原理相同
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 78g苯中含有的碳碳双键数为3.0NA
B. 4.6g金属钠完全燃烧,转移的电子数为0.4NA
C. 等质量的N2和CO中,原子数均为2.0NA
D. 5.6L(标准状况)O2中含有的质子数为4.0NA
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,其中只有Y为金属元素。W、Y、Z最外层电子数之和为12;W与X、Y与Z分别同周期;X与Z形成的化合物可被氢氟酸腐蚀。下列说法错误的是
A. X与Z形成的化合物属于碱性氧化物 B. Z的氢化物为共价化合物
C. X和Y的原子半径大小:X<Y D. 常温常压下W的单质为气态
难度: 中等查看答案及解析
-
一种将CO2和H2O转换为燃料H2、CO及CH4的装置如图所示(电解质溶液为稀H2SO4)。下列关于该装置的叙述错误的是
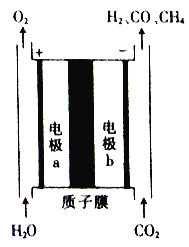
A. 该装置可将电能转化为化学能
B. 工作时,电极a周围溶液的pH增大
C. 电极b上生成CH4的电极反应式为CO2+8H++8e-===CH4+2H2O
D. 若电极b上只产生1 mol CO,则通过质子膜的H+数为2NA
难度: 中等查看答案及解析
-
下列实验方案的设计能够达到实验目的的是
选项
实验目的
实验方案
A
证明HClO是弱酸
用pH试纸测定NaClO溶液的pH
B
比较Mg(OH)2和Fe(OH)3的Ksp大小
分别向2mL浓度均为0.1mol·L-1的MgCl2溶液和FeCl3溶液中滴加几滴0.1mol·L-1的NaOH溶液,观察生成沉淀的颜色
C
验证SO2的还原性
将SO2气体通入溴水中,观察溴水是否褪色
D
实验室制备并检验NH3
加热装有NH4Cl固体的大试管,用湿润的红色石蕊试纸检验产生的气体,观察试纸颜色变化
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
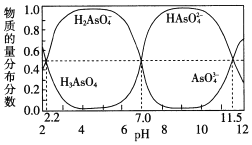
常温下,将NaOH溶液滴入某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示[已知:
]。下列叙述不正确的是
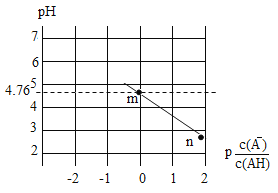
A. Ka(HA)的数量级为10-5
B. 滴加NaOH溶液的过程中,
保持不变
C. m点所示溶液中:c(H+)+c(Na+)=c(HA)+c(OH-)
D. n点所示溶液中:c(Na+)=c(A-)+c(HA)
难度: 中等查看答案及解析