-
砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)ASH3的电子式为___;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为___。
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:
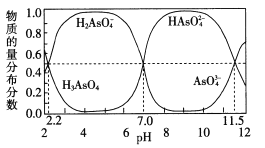
①1gKal ( H3 AsO4)=___;用甲基橙作指示剂,用NaOH溶液滴定H3 ASO4发生的主要反应的离子方程式为___
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g)  H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g)  H2=bkJ/mol
H2=bkJ/mol
则反应4As(g)=As4(g) H=_______kJ/mol(用含a、b的代数式表示)。
H=_______kJ/mol(用含a、b的代数式表示)。
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
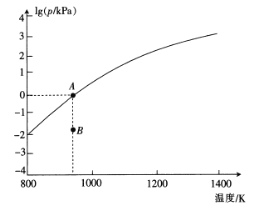
①对应温度下,B点的反应速率v(正) ___v(逆)(填“>’,’’<”或“一”)。
②A点处,AsS(g)的分压为___kPa,该反应的Kp=___kPa5 (Kp为以分压表示的平衡常数)。
-
砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)ASH3的电子式为___;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为___。
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:
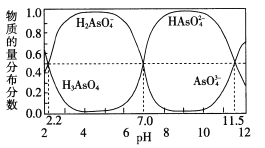
①1gKal ( H3 AsO4)=___;用甲基橙作指示剂,用NaOH溶液滴定H3 ASO4发生的主要反应的离子方程式为___
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g)  H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g)  H2=bkJ/mol
H2=bkJ/mol
则反应4As(g)=As4(g) H=_______kJ/mol(用含a、b的代数式表示)。
H=_______kJ/mol(用含a、b的代数式表示)。
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正) ___v(逆)(填“>’,’’<”或“一”)。
②A点处,AsS(g)的分压为___kPa,该反应的Kp=___kPa5 (Kp为以分压表示的平衡常数)。
-
砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)AsH3的电子式为___。
(2)改变0.1mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO4-、HAsO42-及AsO43-的物质的量分布分数随pH的变化如图所示:
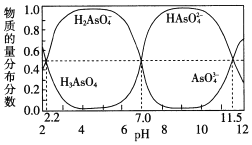
①lgKa1(H3AsO4)=_____。
②用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为___。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分热化学反应如下:
反应Ⅰ.As2O3(g)+3C(s) 2As(g)+3CO(g) △H1=akJ·mol-1
2As(g)+3CO(g) △H1=akJ·mol-1
反应Ⅱ.As2O3(g)+3C(s)
 As4(g)+3CO(g) △H2=bkJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1
反应Ⅲ.As4(g) 4As(g) △H
4As(g) △H
①△H=____kJ·mol-1(用含a、b的代数式表示)。
②反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少。相关数据如下表:
| 反应Ⅱ | 反应Ⅲ |
| 活化能(kJ·mol-1) | 催化剂X | 56 | 75 |
| 催化剂Y | 37 | 97 |
由上表判断催化剂X____(填“优于”或“劣于”)Y,理由是_____。
(4)反应2As2S3(s) 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
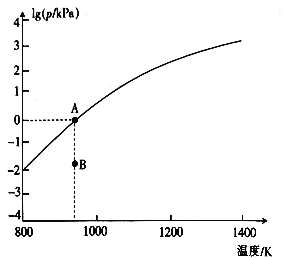
①对应温度下,B点的反应速率v(正)_____v(逆)(填“>”“<”或“=”)。
②A点处,AsS(g)的分压为____kPa,该反应的Kp=_____kPa5(Kp为以分压表示的平衡常数)。
-
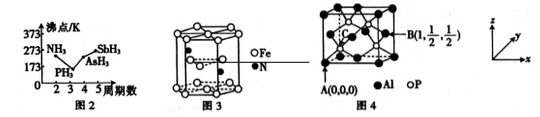
磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:
(1)画出基态P 原子的核外电子排布图__________。
(2) NH3比PH3 易液化的原因是_________。
(3) P4S3可用于制造火柴,其结构如图1所示。
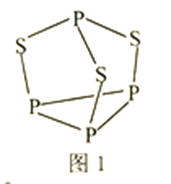
①P4S3中硫原子的杂化轨道类型为________。
②电负性: 磷_____硫(填“>”或“<”);第一电离能磷大于硫的原因是________。
(4)NH4BF4是合成氮化硼纳米管的原料之一,1mol NH4BF4中含有____mol 配位键。
(5)NF3的键角小于NH3的键角,其原因是____________。
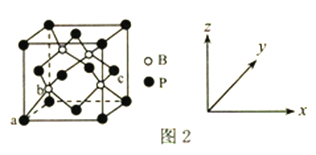
(6) 磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2 所示。原子坐标参数表示晶胞内部各原子的相对位置,图中a 点和c 点的原子坐标参数依次为(0,0,0)、(1, ,
, ),则b点的原子坐标参数为________;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
),则b点的原子坐标参数为________;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
-
磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子的核外电子排布式为____________________。
(2)P4S3可用于制造火柴,其分子结构如图甲所示。
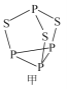
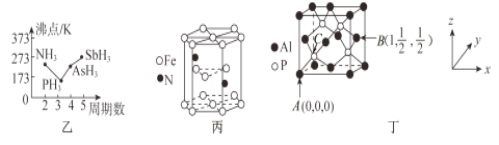
①第一电离能:磷_____________硫;电负性:磷_____________硫(填“>”或“<”)。
②P4S3分子中硫原子的杂化轨道类型为_____________。
③每个P4S3分子中含孤电子对的数目为______________。
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的沸点关系如图乙所示,沸点:PH3<NH3,其原因是____________________;沸点:PH3<AsH3<SbH3,其原因是_____________________________________________________。
②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为_________________。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图丁所示。
①图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为_______________。
②磷化铝晶体的密度为ρg·cm-3用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为_____________________________cm。
-
【化学-选修3:物质结构与性质】磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子核外共有________个未成对的电子。
(2)P4S3可用于制造火柴,其结构如图所示。
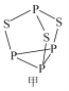
①电负性:磷_______硫;第一电离能:磷_______硫; (填“>”或“<)。
②P4S3中硫原子的杂化轨道类型为_______。
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的沸点关系如图乙所示,沸点:PH33,原因是_______;沸点:PH333,原因是_______。
②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为_______。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图丁所示。
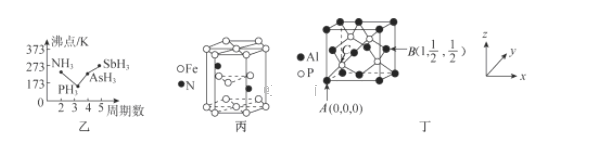
①图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为_______。
②磷化铝晶体的密度为ρg·cm-3用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为_______cm。
-
磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。
回答下列问題:
(1)基态磷原子的核外电子排布式为____________。
(2)P4S3可用于制造火柴,其分子结构如图1所示。
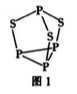
①第一电离能:磷_______硫;电负性;磷_________硫(填“ > ”成“<”)。
②P4S3分子中硫原子的杂化轨道类型为___________。
③每个P4S3分子中含孤电子对的数目为___________。
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的沸点关系如图所示,沸点:PH3<NH3其原因是_________;沸点:PH3<AsH3<SbH3,其原因是_____________。
②某种磁性氮化铁的晶胞结构如图所示,该化合物的化学式为___________。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图所示。
①磷化铝晶体中磷与铝微粒间的作用力为_____________。
②图中A点和B点的原子坐标参数如图所示,则C点的原子坐标参数为_____________。
③磷化铝晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为________cm。
-
磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。
回答下列问題:
(1)基态磷原子的核外电子排布式为____________。
(2)P4S3可用于制造火柴,其分子结构如图1所示。
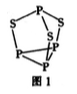
①第一电离能:磷_______硫;电负性;磷_________硫(填“ > ”成“<”)。
②P4S3分子中硫原子的杂化轨道类型为___________。
③每个P4S3分子中含孤电子对的数目为___________。
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的沸点关系如图所示,沸点:PH3<NH3其原因是_________;沸点:PH3<AsH3<SbH3,其原因是_____________。
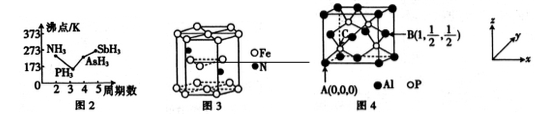
②某种磁性氮化铁的晶胞结构如图所示,该化合物的化学式为___________。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图所示。
①磷化铝晶体中磷与铝微粒间的作用力为_____________。
②图中A点和B点的原子坐标参数如图所示,则C点的原子坐标参数为_____________。
③磷化铝晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为________cm。
-
(1)砷(As)与其化合物被广泛应用在农药、除草剂、杀虫剂以及含砷药物中。回答下列问题:
①砷是氮的同族元素,且比氮多2个电子层,砷在元素周期表中的位置: ;AsH3的热稳定性比NH3的热稳定性 (填“强”或“弱”)。
②As2O3俗称砒霜,As2O3是两性偏酸性氧化物,是亚砷酸(H3AsO3)的酸
酐,易溶于碱生成亚砷酸盐,写出As2O3与足量氢氧化钠溶液反应的离子
方程式 。
③As2S3和HNO3反应如下:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,将该反应设计成原电池,则NO2应该在 (填“正极”或“负极”)附近逸出,该极的电极反应式为 。
(2)综合利用CO2对环境保护及能源开发意义重大。Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是 。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
-
氮和磷元素的单质和化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列问题:
(1)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为___,其中的阴离子的空间构型为___。
(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子的形式存在。N4H44+根系易吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。1个N4H44+中含有___个σ键。
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因___。
(4)P4S3可用于制造火柴,其分子结构如图1所示。
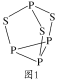
①P4S3分子中硫原子的杂化轨道类型为___。
②每个P4S3分子中含孤电子对的数目为___。
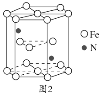
(5)某种磁性氮化铁的晶胞结构如图2所示,该化合物的化学式为___。若晶胞底边长为anm,高为cnm,则这种磁性氮化铁的晶体密度为__g·cm−3(用含a、c和NA的式子表示)
(6)高温超导材料,是具有高临界转变温度(Te)能在液氮温度条件下工作的超导材料。高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为[Ar]__;化合物中,稀土元素最常见的化合价是+3,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是___(填元素符号)。
几种稀土元素的电离能(单位:kJ·mol−1)
| 元素 | I1 | I2 | I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 7019 |
| Y(铱) | 616 | 1181 | 1980 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3547 |

2As(g)+3CO(g) △H1=akJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1
4As(g) △H
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
















