-
元素性质呈周期性变化的原因是( )
A. 相对原子质量逐渐增大 B. 核电荷数逐渐增大
C. 核外电子排布呈周期性变化 D. 元素的化合价呈周期性变化
难度: 简单查看答案及解析
-
下列物质的分子中,不含共价键的是( )
A. NaCl B. Cl2 C. HCl D. NaOH
难度: 中等查看答案及解析
-
在下列有关晶体的叙述中错误的是 ( )
A. 离子晶体中,一定存在离子键 B. 原子晶体中,只存在共价键
C. 金属晶体的熔沸点均很高 D. 稀有气体的原子能形成分子晶体
难度: 简单查看答案及解析
-
以下互为同素异形体的是 ( )
A. 金刚石与石墨 B. D2与H2
C. CO与CO2 D.
Cl与
Cl
难度: 中等查看答案及解析
-
属于同分异构体的是 ( )
A. O2和O3 B.
和
C. H2O与H2O2 D. C2H5COOH与CH3COOCH3
难度: 中等查看答案及解析
-
下列气态氢化物中最不稳定的是 ( )
A. PH3 B. NH3 C. H2O D. H2S
难度: 中等查看答案及解析
-
下列微粒中:①
②
③
④
,其核外电子数相同的是( )
A. ①②③ B. ②③④ C. ①②④ D. ①③④
难度: 简单查看答案及解析
-
下列各组顺序的排列不正确的是 ( )
A. 原子半径:Na<Mg<Al B. 热稳定性:HCl>H2S>PH3
C. 酸性强弱:H2SiO3<H2CO3<H3PO4 D. 熔点:SiO2>NaCl>CO2
难度: 困难查看答案及解析
-
下列晶体中,化学键种类相同,晶体类型也相同的是( )
A. SO2和SiO2 B. CO2和H2O C. NaCl和HCl D. Cl2和KCl
难度: 困难查看答案及解析
-
共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,只含有上述一种作用的是( )
A. 干冰 B. 氯化钠 C. 氢氧化钠 D. 碘
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 同周期元素的原子半径以ⅦA族的为最大
B. 在周期表中零族元素的原子既不容易失电子也不容易得电子
C. 同一周期元素的原子,其半径越大越容易得电子
D. 所有主族元素的原子形成单原子离子时的最高价数都和它的族序数相等
难度: 中等查看答案及解析
-
已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是( )
A. X的能量一定低于M的,Y的能量一定低于N的
B. 因为该反应为吸热反应,故一定要加热反应才能进行
C. 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D. X和Y的总能量一定低于M和N的总能量
难度: 简单查看答案及解析
-
镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述不正确的是
A. 在化合物中呈+2价 B. 单质能与水反应,放出氢气
C. 氢氧化物呈两性 D. 碳酸盐难溶于水
难度: 中等查看答案及解析
-
下列物质属于共价化合物的是
A. NaOH B. NH4F C. HNO3 D. MgCl2
难度: 中等查看答案及解析
-
下列关于化学平衡状态的叙述错误的是( )
A. 正、逆反应速率相等
B. 反应混合物各自的物质的量不再改变
C. 正、逆反应停止不再进行
D. 外界条件改变,反应会在新的条件下达到新的平衡
难度: 简单查看答案及解析
-
在密闭容器中通人一定量的HI气体,使其在一定条件下发生反应:2HI
H2+I2 (气) 。下列叙述中一定属于平衡状态的是:
A. HI、H2、I2的浓度相等
B. 混合气体的颜色不变化时
C. 混合气体的总压不变时
D. v(HI):v(H2):v(I2)=2:1:1时
难度: 中等查看答案及解析
-
在N2+3H2
2NH3反应中,自反应开始至2s末,氨的浓度由0变为0.4 mol·L-1,则以氢气的浓度变化表示该反应在2s内的平均反应速率是( )
A. 0.3mol·L-1·S-1 B. 0.4 mol·L-1·S-1 C. 0.6 mol·L-1·S-1 D. 0.8 mol·L-1·S-1
难度: 简单查看答案及解析
-
在不同条件下,分别测得反应2SO2+O2
2SO3的化学反应速率,其中表示该反应进行得最快的是 ( )
A. v(SO2)=4mol·L-1·min-1 B. v(O2)=3mol·L-1·min-1
C. v(SO3)=0.1mol·L-1·s-1 D. v(O2)=0.1mol·L-1·s-1
难度: 中等查看答案及解析
-
燃烧1g乙炔(C2H2)气体,生成液态水和二氧化碳,放出50kJ热量,则燃烧3mol乙炔所放出的热量为( )
A. 50kJ B. 150kJ C. 450kJ D. 3 900kJ
难度: 简单查看答案及解析
-
如图表示某气体反应的能量变化示意图,据此分析下列判断错误的是( )
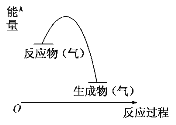
A. 这是一个放热反应
B. 该反应可能需要加热
C. 生成物的总能量低于反应物的总能量
D. 断开反应物的化学键所吸收的能量大于形成生产物的化学键所放出的能量。
难度: 简单查看答案及解析