-
我国突飞猛进的新科技深刻改变着人类的生活、生产方式。下列说法错误的是
A. 太阳能光伏发电系统能将光能转化为电能
B. “嫦娥四号”使用的SiC-A1材料属于复合材料
C. 华为自主研发的5G芯片巴龙5000的主要材料是SiO2
D. 我国自主研发的东方超环(人造太阳)使用的氚、氘与氕互为同位素
难度: 中等查看答案及解析
-
2019年“两会”政府工作报告指出:开展蓝天、碧水、净土保卫战。煤的综合利用可减少直接燃烧造成的污染。下列有关煤干馏的产品说法正确的是
A.
和
互为同系物
B.
 的一氯代物共有3种
的一氯代物共有3种C. CH2=CH2水化制乙醇属于取代反应
D. 甲烷能被氧气或酸性高锰酸钾溶液氧化
难度: 困难查看答案及解析
-
下列装置能达到实验目的的是
A.
 配制0.1mol·L-1NaCl溶液
配制0.1mol·L-1NaCl溶液B.
 检验石蜡油分解产生了不饱和烃
检验石蜡油分解产生了不饱和烃C.
 用渗析法分离葡萄糖与氯化钠的混合液
用渗析法分离葡萄糖与氯化钠的混合液D.
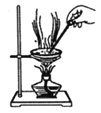 用陶瓷蒸发皿加热NaOH溶液获得纯净的NaOH固体
用陶瓷蒸发皿加热NaOH溶液获得纯净的NaOH固体难度: 困难查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期主族元素。W的单质与H2在暗处能剧烈化合并发生爆炸,X的周期数等于族序数,X与Y形成的化合物与水反应产生白色沉淀和H2Y气体。下列说法正确的是
A. 简单离子半径:W<X<Z
B. 简单阴离子的还原性:W<Y<Z
C. 元素的最高正化合价:X<Y<W
D. X、Z的最高价氧化物的水化物之间能反应
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 14g乙烯中所含氢原子数为2NA
B. 6g14C原子中所含中子数为4NA
C. 标准状况下2.24LHC1气体中所含H+数为0.1NA
D. 0.1mol氯气溶于水制成饱和氯水,转移电子数目为0.1NA
难度: 困难查看答案及解析
-
镁电池作为一种低成本、高安全的储能装置,正受到国内外广大科研人员的关注。一种以固态含Mg2+的化合物为电解质的镁电池的总反应如下。下列说法错误的是
xMg+V2O5
MgxV2O5
A. 充电时,阳极质量减小
B. 充电时,阴极反应式:Mg2++2e-=Mg
C. 放电时,正极反应式为:V2O5+xMg2++2xe-=MgxV2O5
D. 放电时,电路中每流过2mol电子,固体电解质中有2molMg2+迁移至正极
难度: 困难查看答案及解析
-
已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH与离子浓度的变化关系如图所示。下列叙述错误的是
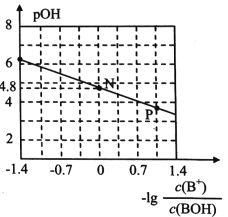
A. BOH属于弱碱
B. BOH的电离常数K=1×10-4.8
C. P点所示的溶液中:c(Cl-)>c(B+)
D. N点所示的溶液中:c(H+)=c(Cl-)+c(OH-)-c(BOH)
难度: 困难查看答案及解析
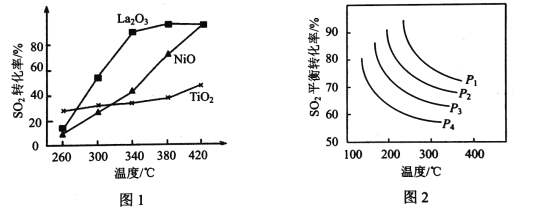
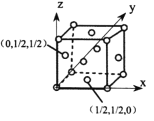
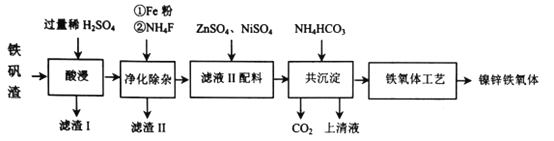
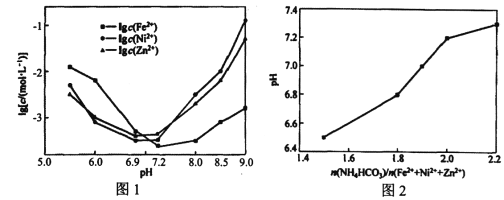

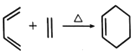
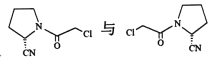 的关系是___________(填标号)
的关系是___________(填标号)