-
下列表述正确的是( )
A. 硅晶体具有半导体性能,可用于光导纤维
B. 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
C. 浓硫酸具有吸水性,故能使蔗糖炭化
D. SO2能使酸性KMnO4溶液褪色,体现了SO2的漂白性
难度: 中等查看答案及解析
-
下表各组物质在适当条件均可反应,其中气体(指常温时的状态)产物可能不唯一的是( )
A. 浓硫酸与锌 B. 浓硫酸与铜 C. 浓盐酸与MnO2 D. 浓氨水与CaO
难度: 中等查看答案及解析
-
下列除杂的操作方法,正确的是( )
A. NO中混有少量NO2气体:用水洗涤后再干燥
B. 食盐中混有少量NH4Cl:加过量烧碱溶液后加热蒸干
C. NH3中混有少量水蒸气:通过装有浓硫酸的洗气瓶
D. 硝酸混有少量硫酸:加适量BaCl2后再过滤
难度: 中等查看答案及解析
-
下列关于指定粒子构成的几种描述中不正确的是( )
A. H3O+与 OH-具有相同的质子数和电子数
B. 第85号元素的最高价为+7价
C. 37Cl与39K具有相同的中子数
D. 147N与157N得电子能力相同
难度: 简单查看答案及解析
-
某元素X最高价含氧酸的化学式为H3XO4,则其气态氢化物为( )
A. HX B. H2X C. XH4 D. XH3
难度: 中等查看答案及解析
-
下列叙述中能肯定说明金属A比金属B的活泼性强的是
A. A原子最外层电子数比B原子的最外层电子数少
B. A原子电子层数比B原子的电子层数多
C. 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多
D. 常温时,A能从酸中置换出氢,而B不能
难度: 中等查看答案及解析
-
工业上制备硫酸常用接触法,工业上制硝酸常用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是( )
A. 在沸腾炉中进行的反应为:4FeS2+11O2
2Fe2O3+8SO2
B. 工业上制硫酸与硝酸都用到同一工艺设备:吸收塔
C. 硫酸工业、硝酸工业都需要对工业尾气进行处理
D. 工业上制备硫酸和制硝酸涉及的反应都属于氧化还原反应
难度: 中等查看答案及解析
-
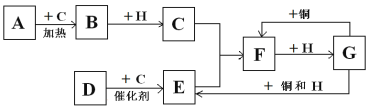
能实现下列物质间直接转化的元素是( )
单质
氧化物
酸或碱
 盐
盐A. 氮 B. 硫 C. 铁 D. 铜
难度: 中等查看答案及解析
-
已知气体的摩尔质量越小,扩散速度越快。下图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是( )

A. 甲是浓氨水,乙是浓硫酸
B. 甲是浓盐酸,乙是浓氨水
C. 甲是浓氨水,乙是浓盐酸
D. 甲是浓硫酸,乙是浓氨水
难度: 中等查看答案及解析
-
X、Y、Z均为元素周期表中前20号元素,Xa+、Yb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是( )
A. 已知mXa+与nYb-,得m+a=n-b B. 离子半径:Yb->Z(b+1)->Xa+
C. Z(b+1)-的还原性大于Yb- D. 气态氢化物的稳定性Hb+1Z一定大于HbY
难度: 简单查看答案及解析
-
对于100mL 1mol/L盐酸与铁片的反应,采取下列措施能使反应速率加快的是:( )
①升高温度;
②改用100mL 3mol/L盐酸;
③多用300mL 1mol/L盐酸;
④用等量铁粉代替铁片;
⑤改用98%的硫酸
A.①③④ B.①②④ C.①②③④ D.①②③⑤
难度: 简单查看答案及解析
-
在合成氨的反应中,在5s中N2由6mol/L减至2mol/L。则NH3的平均反应速率是( )
A. 2.4 mol/(L•s) B. 1.6mol/(L•s)
C. 0.8 mol/(L•s) D. 0.08 mol/(L•s)
难度: 中等查看答案及解析
-
以下实验目的可以实现的是( )
A.
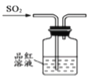 验证一定生成SO2 B.
验证一定生成SO2 B.  制备氨气
制备氨气C.
 证明碳酸酸性强于硅酸 D.
证明碳酸酸性强于硅酸 D. 收集NO
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是Y元素的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如图所示。下列说法正确的是( )
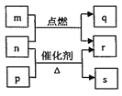
A. q与s均为酸性氧化物 B. Z的含氧酸是一种强酸
C. X、Y分别与W形成10e-的微粒能反应生成一种气体 D. 原子半径:W<Y<X
难度: 中等查看答案及解析
-
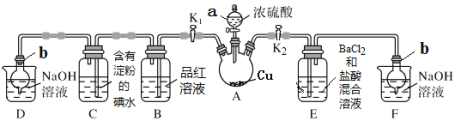
CO2通入BaCl2溶液中并不产生沉淀,在下图右侧的Y形管中放置合适的药品,进行合理操作,在BaCl2溶液中可以看到白色沉淀.右侧Y形管中放的药品是( )

A. Cu和浓硝酸 B. CaO和浓氮水
C. Na2SO3和较浓硫酸 D. KMnO4溶液和浓盐酸
难度: 中等查看答案及解析
-
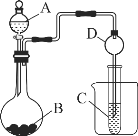
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
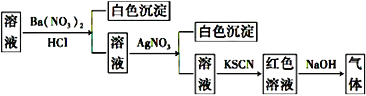
A. 原溶液中一定含有SO42- B. 原溶液中一定含有NH4+
C. 原溶液中一定含有Cl- D. 原溶液中一定含有Fe3+
难度: 中等查看答案及解析
-
一定条件下,将等体积的NO2和O2的混合气体置于试管并将该试管倒置于水槽中至液面不再上升时,剩余气体的体积约为原体积的( )
A. 1/4 B. 3/4 C. 1/8 D. 3/8
难度: 中等查看答案及解析
-
稀H2SO4 和稀HNO3的混合液1L,其物质的量浓度分别为0.4mol·L-1和0.1mol·L-1。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
A. 2.4g B. 3.2g C. 6.4g D. 9.6g
难度: 中等查看答案及解析