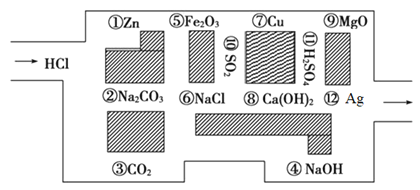
-
菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法中,正确的是( )
A. 在该反应中维生素C作催化剂
B. 由上述信息可推知砒霜中含有的砷是+3价的
C. 因为河虾中含有砷元素,所以不能食用
D. 上述反应中维生素C作氧化剂
难度: 中等查看答案及解析
-
已知酸性溶液中还原性的顺序为SO32->I->Fe2+>Br->Cl-,下列反应不能发生的是
A. 2Fe3++SO32-+H2O→2Fe2++SO42-+2H+ B. I2+ SO32-+H2O→SO42-+2I-+2H+
C. 2Fe2++I2→2Fe3++2I- D. Br2+SO32-+H2O→SO42-+2Br-+2H+
难度: 中等查看答案及解析
-
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为( )
A. 10mol B. 11mol C. 12mol D. 13mol
难度: 中等查看答案及解析
-
下列说法正确的是
A. 物质不是电解质就是非电解质
B. 酸性氧化物不一定都是非金属氧化物,而非金属氧化物一定是酸性氧化物
C. 能导电的物质不一定是电解质,电解质也不—定能导电
D. 液氨溶于水能导电,所用是电解质
难度: 中等查看答案及解析
-
对四组无色透明溶液进行离子检验,四位同学各鉴定一组,他们的实验报告的结论如下,其中可能正确的是
A. MnO4-、K+、S2-、Na+
B. Mg2+、NO3-、OH-、Cl-
C. K+、H+、Cl-、CO32-
D. Na+、OH-、Cl-、NO3-
难度: 中等查看答案及解析
-
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A. H2O2 B. IO3- C. MnO4- D. HNO3
难度: 中等查看答案及解析
-
将下列各组物质按酸、碱、盐的分类依次排列,正确的是( )
A. 硫酸、纯碱、石膏 B. 硫酸、烧碱、胆矾
C. 硫酸氢钠、生石灰、醋酸钠 D. 磷酸、熟石灰、苛性钠
难度: 简单查看答案及解析
-
把过氧化钠投入含有HCO3-、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是( )
A. HCO3- B. Cl- C. Mg2+ D. Na+
难度: 中等查看答案及解析
-
下列化学实验操作中均要用到玻璃棒,其中玻璃棒作用相同的是
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体 ⑤测溶液的pH值
A. ①②④ B. ②③⑤ C. ①和④ D. ③和④
难度: 简单查看答案及解析
-
下列物质的分离方法错误的是
A.采用蒸发法从食盐水中提取食盐
B.用结晶法除去硝酸钾中的氯化钠
C.用酒精从溴水中萃取溴
D.用分液法分离汽油和水的混合物
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
B. 往Fe(OH)3胶体中逐滴加入稀H2SO4时,开始时会出现沉淀,再继续滴加时,沉淀又会消失
C. Fe(OH)3胶体粒子在电场影响下将向阴极运动,说明Fe(OH)3胶体带正电
D. 分离胶体和某盐溶液,可用过滤的方法
难度: 中等查看答案及解析
-
下列实验操作中错误的是
A. 萃取操作振荡时,用右手压住分液漏斗口部,用左手握住活塞部分
B. 蒸馏操作时,冷却水应从冷凝管的下口进,上口出
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作选择有机萃取剂时,萃取剂的密度必须比水大
难度: 中等查看答案及解析
-
下列说法正确的是
A. 加入盐酸以除去硫酸钠中的少量碳酸钠杂质
B. 配制溶液定容时,用胶头滴管滴加蒸馏水至溶液凹液面最低点与刻度线相切
C. 未经打磨的铝箔和经过打磨的铝箔充分加热后,前者液滴不滴落而后者滴落
D. 做焰色反应的实验时,先用稀硫酸润洗铂丝,然后在酒精灯上充分灼烧。
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
A. 45g水中含有的水分子数是2.5NA
B. 标准状况下,33.6L CO中含有的原子数是3NA
C. 0.5L、0.2mol/L的NaCl溶液中含有的Na+ 数是0.1NA
D. 1 mol CH4含电子数目为8NA
难度: 中等查看答案及解析
-
在Na2SO4和Al2(SO4)3混合溶液中,测得Al3+浓度为0.1mol/L, SO42- 浓度为0.3mol/L,则混合溶液中Na+的浓度为( )
A. 0.15mol/L B. 0.45mol/L C. 0.6mol/L D. 0.3mol/L
难度: 中等查看答案及解析
-
下列关于钠的说法中不正确的是
A.金属钠和氧气反应,条件不同,产物则不同
B.钠长期放置在空气中,最终将变成碳酸钠
C.钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中
D.将一小块钠投入氯化铁溶液时,既能产生气体又会出现白色沉淀
难度: 简单查看答案及解析
-
相等物质的量的CO和CO2的下列比较中正确的是( )
①所含的分子数目之比为1:1 ②所含的O原子数目之比为1:2
③所含的原子总数目之比为2:3 ④所含的C原子数目之比为1:1
⑤它们的质量之比为7:11
A.①② B.②③ C.④⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于阴影部分的是
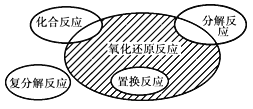
A. Cl2+2KBr=Br2+2KCl
B. 2NaHCO3
Na2CO3+H2O+CO2↑
C. 3Mg+N2
Mg3N2
D. 2Na2O2+2CO2=2Na2CO3+O2
难度: 中等查看答案及解析
-
有人设想将碳酸钙通过特殊的加工方法使之变为纳米碳酸钙(即碳酸钙粒子直径是纳米级),这将引起建筑材料的性能发生巨变。下列关于纳米碳酸钙的推测可能正确的是( )
A. 纳米碳酸钙是与胶体相似的分散系
B. 纳米碳酸钙会产生丁达尔效应
C. 纳米碳酸钙化学性质已与原来碳酸钙完全不同
D. 纳米碳酸钙的粒子能透过滤纸
难度: 中等查看答案及解析
-
重金属离子具有毒性,如Cu2+、Ba2+,实验室中有甲、乙两种含重金属离子的废液,甲废液经化验呈碱性,所含阳离子主要是Ba2+。如将甲、乙两废液按一定比例混合,毒性明显降低,则乙废液中可能含有的离子是
A. Cu2+和SO42- B. Cu2+和Cl- C. K+和SO42- D. Ag+和NO3-
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种易溶于水的物质,分别由 NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3—、SO42—中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;②0.1 mol/L乙溶液中c(H+)>0.1 mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
A. 甲溶液含有Ba2+ B. 乙溶液含有SO42-
C. 丙溶液含有Cl- D. 丁溶液含有Mg2+
难度: 困难查看答案及解析
-
标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达不正确的是
A. 体积②>③>①>④
B. 密度②>③>④>①
C. 质量②>③>①>④
D. 氢原子个数①>④>③>②
难度: 中等查看答案及解析
-
常温下在溶液中可发生如下两个反应:Ce4++Fe2+ = Fe3++Ce3+、Sn2++2Fe3+ = 2Fe2++Sn4+由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
A. Sn2+、Fe2+、Ce3+ B. Ce3+、Fe2+、Sn2+
C. Sn2+、Ce3+、Fe2+ D. Fe2+、Sn2+、Ce3+
难度: 中等查看答案及解析
-
常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CO2的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述中正确的是
A. 0.1 mol/L稀硫酸中含有硫酸根数目为0.1NA
B. 1 mol Na2O2与足量H2O反应,转移电子数为2NA
C. 2.4g金属镁与足量的盐酸反应,生成氢分子数目为2NA
D. lmolNH4+中含有电子数为10NA
难度: 中等查看答案及解析
-
CaH2常作为生氢剂,其中氢元素呈-1价,其化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑,其中水是
A. 还原剂 B. 氧化剂 C. 既是还原剂又是氧化剂 D. 既不是氧化剂又不是还原剂
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A. NaHSO4溶液中加入Ba(OH)2溶液后恰好显中性Ba2++OH-+H++SO42-=BaSO4+H2O
B. 向澄清石灰水中通入过量CO2:OH-+CO2=HCO3-
C. 氧氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4
D. 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式为
A. NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-= CO32-+NH3↑+H2O
B. 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-=CaCO3↓+2OH-
C. 稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑
D. 醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
难度: 中等查看答案及解析
-
在反应H2S+H2SO4(浓)=S↓+SO2↑+2H2O中,若有32g硫生成则转移电子的物质的量为
A. 6mol B. 2mol C. 3mol D. 4mol
难度: 中等查看答案及解析
-
工业上冶炼锡的第一步反应原理为2SnO2+3C=2Sn+aM↑+CO2↑,则下列说法中错误的是
A. 反应中SnO2被还原
B. a的值为3
C. 反应后元素化合价升髙生成的物质有两种
D. 每生成lmolCO2转移电子8mol
难度: 中等查看答案及解析
-
小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++□(未配平)。关于此反应的叙述正确的是( )
A. 该反应的氧化剂是H2C2O4 B. 1molMnO4-在反应中失去5mol电子
C. 该反应右框内的产物是OH- D. 配平该反应后,H+的计量数是6
难度: 中等查看答案及解析
-
相同物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气;②若不使用催化剂,加热至470℃左右,得到KClO4(高氯酸钾)和KCl.下列关于①和②的说法不正确的是( )
A. 都属于氧化还原反应
B. 发生还原反应的元素相同
C. 发生氧化反应的元素不同
D. 生成KCl的物质的量相同
难度: 中等查看答案及解析
-
某溶液中含四种离子,己知其中三种离子Na+、Mg2+、NO3-的物质的量浓度分别为0.2mol·L-1,0.l mol·L-1,0.l mol·L-1,则溶液中另一离子及其物质的量浓度可能是( )
A. SO42- 0.l mol·L-1 B. Al3+ 0.2 mol·L-1
C. Cl- 0.3 mol·L-1 D. K+ 0.4mol·L-1
难度: 中等查看答案及解析
-
某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是
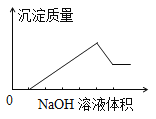
A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
难度: 困难查看答案及解析
-
将3.72g金属钠、氧化钠和过氧化钠的混合物与足量水反应,在标准状况下得到672mL混合气体,将混合气体电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为( )
A. 3:2:1 B. 4:2:1 C. 2:1:1 D. 1:1:1
难度: 困难查看答案及解析