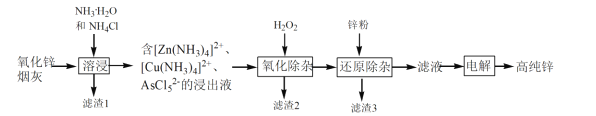
-
二氧化碳气体能引起温室效应,“碳捕捉技术”可实现二氧化碳的分离、储存和利用,其工艺流程示意图如下,下列叙述中正确的是( )

A. CO2是引起酸雨的主要物质之一
B. 能源消耗低是该技术的一大优点
C. 捕捉CO2可使用小苏打溶液
D. 捕捉到的CO2可作化工原料
难度: 简单查看答案及解析
-
三氯生(常作抗菌剂)的一种衍生物结构如下图所示。关于该衍生物的说法不正确的是( )
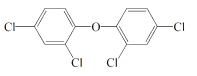
A. 分子式为C12H6Cl4O B. 是二氯苯的同系物
C. 其一溴代物有三种 D. 能发生加成反应
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,22.4 L己烯中含有碳氢键数目为12NA
B. 5.6 g Fe与足量盐酸完全反应,失去电子数目为0.2NA
C. 0.1 mol N2与0.3 mol H2充分反应,生成NH3的数目为0.2NA
D. 电解精炼铜时阳极减轻32 g,电路中转移电子数目一定为NA
难度: 简单查看答案及解析
-
下列实验中,为达到实验目的所用的实验操作和原理解释都正确的是( )
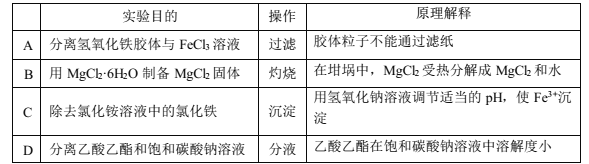
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
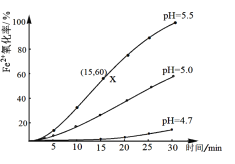
X、Y、Z、W是第三周期元素,它们最高价氧化物对应的水化物溶于水,得到浓度均为0.010mol/L的溶液,其pH(25℃)与对应元素原子半径的关系如图所示。下列说法正确的是( )
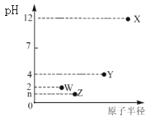
A. 简单离子的半径:X>Z>W
B. 简单气态氢化物的稳定性:Z>W>Y
C. Y单质可用于制作半导体材料
D. n =2-lg2
难度: 中等查看答案及解析
-
用Li和石墨的复合材料以及纳米Fe2O3材料作电极的锂离子电池,在循环充放电过程中可实现对磁性的可逆调控(如图)。下列有关说法一定错误的是
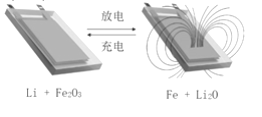
A. 该电池的电解质溶液可以是硫酸溶液
B. 放电时,总反应式是6Li+Fe2O3=3Li2O+2Fe
C. 充电时,阳极的电极反应是2Fe+3Li2O-6e-= Fe2O3+6Li+
D. 充放电过程中,电池可在被磁铁不吸引和吸引之间循环调控
难度: 中等查看答案及解析
-
常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
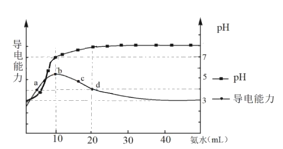
A. 各点溶液中的离子浓度总和大小关系:d>c > b > a
B. 常温下,R-的水解平衡常数数量级为10 -9
C. a点和b点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3∙H2O)
难度: 中等查看答案及解析