-
FeSO4是一种补血剂,常温下久置易变黄,一般认为是二价铁被氧化为三价铁的缘故。
(1)已知:①Fe2+(aq)-e-= Fe3+(aq) △H1=akJ/mol
②O2(g)+4 e-+4H+(aq)=2H2O(l) △H2=bkJ/mol
则FeSO4在酸性溶液中变质的热化学方程式为_____ 。
常温下,配制浓度为0.1mol/L的FeSO4溶液,研究不同 pH 对Fe2+ 氧化的影响,结果如下图所示,(假设反应过程中溶液体积不变)。
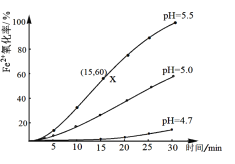
(2)在pH=5.5的环境下,该反应在0~15min的平均速率v(Fe2+)=_______;增大溶液pH,Fe2+被氧化速率_______(填“增大”、“减小”或“无影响”)。
(3)在平衡常数的计算中气态物质常以压强代替其浓度,Fe2+在酸性环境下氧化的平衡常数K的计算表达式是______;常温下该反应的平衡常数很大,为2.5×1032L4 /(atm∙mol4),下列说法正确的是_______。
a. Fe2+转化为Fe3+的趋势大 b. Fe2+转化为Fe3+的速率大
c. 反应进行得较为彻底 d. 酸性条件下Fe2+不会被氧化
(4)在pH=13的环境下,Fe2+的氧化变质可以理解为:
第一步: Fe2++2OH-= Fe(OH)2,第二步_____________ (用化学方程式回答);当氧化达到平衡时,c(Fe2+)/ c(Fe3+)_____4.0×1022(填“>”“<”或“=”)。已知的Ksp[Fe(OH)3]=2.5×10-39,Ksp[Fe(OH)2]=1.0×10-15。
(5)根据上述分析,配制FeSO4溶液的正确方法是加入适量的铁粉和_________。
-
FeSO4是一种补血剂,常温下久置易变黄,一般认为是二价铁被氧化为三价铁的缘故。
(1)已知:①Fe2+(aq)-e-= Fe3+(aq) △H1=akJ/mol
②O2(g)+4 e-+4H+(aq)=2H2O(l) △H2=bkJ/mol
则FeSO4在酸性溶液中变质的热化学方程式为_____ 。
常温下,配制浓度为0.1mol/L的FeSO4溶液,研究不同 pH 对Fe2+ 氧化的影响,结果如下图所示,(假设反应过程中溶液体积不变)。
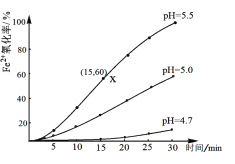
(2)在pH=5.5的环境下,该反应在0~15min的平均速率v(Fe2+)=_______;增大溶液pH,Fe2+被氧化速率_______(填“增大”、“减小”或“无影响”)。
(3)在平衡常数的计算中气态物质常以压强代替其浓度,Fe2+在酸性环境下氧化的平衡常数K的计算表达式是______;常温下该反应的平衡常数很大,为2.5×1032L4 /(atm∙mol4),下列说法正确的是_______。
a. Fe2+转化为Fe3+的趋势大 b. Fe2+转化为Fe3+的速率大
c. 反应进行得较为彻底 d. 酸性条件下Fe2+不会被氧化
(4)在pH=13的环境下,Fe2+的氧化变质可以理解为:
第一步: Fe2++2OH-= Fe(OH)2,第二步_____________ (用化学方程式回答);当氧化达到平衡时,c(Fe2+)/ c(Fe3+)_____4.0×1022(填“>”“<”或“=”)。已知的Ksp[Fe(OH)3]=2.5×10-39,Ksp[Fe(OH)2]=1.0×10-15。
(5)根据上述分析,配制FeSO4溶液的正确方法是加入适量的铁粉和_________。
-
久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某硏究小组为硏究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。
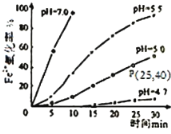
回答下列问题:
(1)写出Fe2+水解的离子方程式___;要抑制FeSO4水解,可以采取的措施是___。
(2)若配制的FeSO4溶液浓度为0.01mol/L,反应过程中溶液体积不变,计算图中P点Fe2+的氧化速率___。
(3)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O2+4H+ 4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是___。
4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是___。
a.Fe2+转化为Fe3+的趋势很大
b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全
d.酸性条件下Fe2+不会被氧化
(4)结合图分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响___。
(5)用K2Cr2O7标准溶液測定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O,若取20mL待测溶液,用0.0200mol·L−1K2Cr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=___mol·L−1。
-
实验室以H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂制备三氯化六氨合钴(III)配合物(活性的二价钴氨配合物氧化为惰性的三价钴氨配合物)的流程如下:
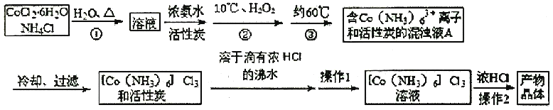
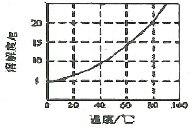
已知:Co(NH3)6Cl3在不同温度下水中的溶解度曲线如图。
(一)三氯化六氨合钴(III)配合物的制备
(1)步骤②中要冷却至10℃再缓慢地边搅拌边加入H2O2溶液,这样操作的目的是:________。
(2)实验室制备三氯化六氮合钴(III)总反应化学方程式为:_______________________。
(3)实验操作1为______________。操作2在[Co(NH3)6]Cl3溶液中加入浓盐酸的目的是____________________________________________。
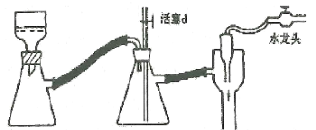
(4)实验中用到减压抽滤装置如图,当抽滤完毕或中途停止抽滤时,应当采取的正确操作过程是_________________。
(二)产品中NH3含量的测定
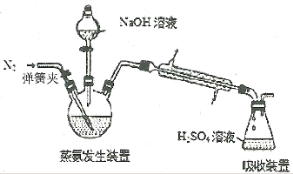
现称取0.1000g产品,在三颈烧瓶中发生如下反应:
[Co(NH3)x]Cl3+3NaOH=Co(OH)3↓+xNH3↑+3NaCl(见下图),锥形瓶中装有10.00mL c mol·L-1 H2SO4,加热烧瓶,使NH3完全逸出。滴加2滴指示剂,用0.5000mol·L-1 NaOH标准溶液滴定,滴定达到终点时消耗NaOH溶液V mL。
(5)下列关于实验的说法不正确的是______________。
A.第①步需在NH4Cl溶液中加入研细的CoCl2·6H2O晶体,目的是加速固体的溶解
B.原料NH4Cl的主要作用是抑制NH3·H2O的电离,有利于生成二价钴氨配合物,不形成Cu(OH)2
C.减压过滤涉及转移溶液,具体是:用倾析法先转移溶液,后开大水龙头,待溶液快流尽时再转移沉淀
D.第④步中使用含有盐酸的沸水,促进产品的析出
E.滴定时加入的2滴指示剂是酚酞
(6)根据实验(二)的数据计算:晶体中NH3的质量分数为__________(用含字母的式子表示)。
-
(16分)
某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:
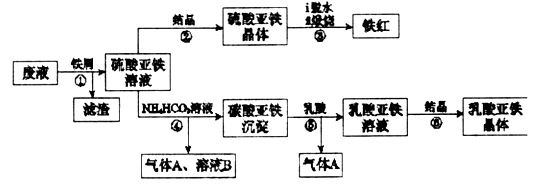
已知:①TiOSO4可溶于水,在水中可以电离为Ti02+和SO4 :
:
②TiOSO4水解的反应为:
请回答:
(1)步骤①所得滤渣的主要成分为______________________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为__________________。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是__________________________________。
(5)已知: ,试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_________________________________________________________。
,试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_________________________________________________________。
(6)溶液B常被用于电解生产(NH4)2S208(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
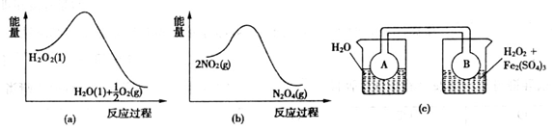
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________________。
-
(16分)某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:
已知:
①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-:
②)TiOSO4水解的反应为:TiOSO4+(x+1)H2O=TiO2∙xH2O↓+H2SO4
请回答:
(1)步骤①所得滤渣的主要成分为__________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比_______。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是______________________。
(5)已知:FeCO3(s)  Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
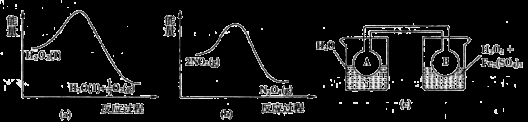
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________。
-
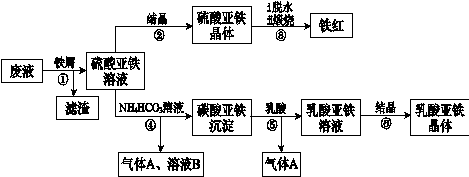
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是________________________。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、________________________________。
(1)步骤④的离子方程式是________。
(1)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及________________________。
(1)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为________________________。
(1)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因________。
(1)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)________。
-
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
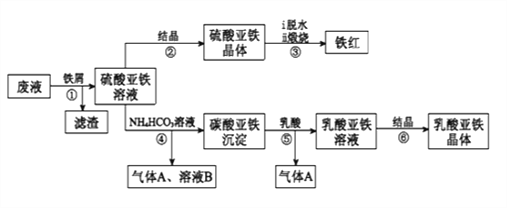
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2•xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2•xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_________________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________。
(5)步骤④的离子方程式是_________________________________________。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______________(用a表示)。
-
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如图:
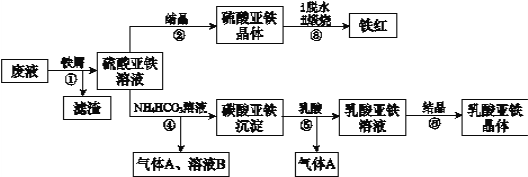
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是______________________。
(2)滤渣的主要成分为TiO2•xH2O,写出TiOSO4水解生成TiO2•xH2O的化学方程式为_____。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为______________。
(4)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 ____________________________。
(5)步骤④的离子方程式为___________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_________。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)___________________。
-
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、 TiOSO4]生产铁红和补血剂乳酸亚铁。其生产步骤如下:
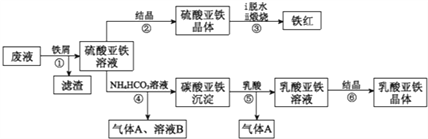
已知:TiOSO4可溶于水,在水中可以电离为TIO2+和SO42-,TiOSO4水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OHCOOH.请回答:
(1)步骤①中分离硫酸重铁溶液和滤渣的操作是______________。
(2)加入铁屑的目一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2·xH2O滤渣,用平衡移动的原理解释得到滤渣的原因_______________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_____________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因___________________。
(5)步骤④的离子方程式是________________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_______________。
(7)乳酸亚佚晶体{[CH3CH(OH)COO]2Fe·3H2O}纯度的测量:若用KMnO4滴定法测定样品中Fe的量进而计算纯度时,发现结果总是大于100%,其原因可能是_______________。
经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00mL,用0.1000mol/LCe(SO4)2标准溶液滴定至终点记录数据如下表。
| 滴定次数 | 0.1000mol/LCe(SO4)2标准溶液/mL |
| 滴定前读数 | 滴定后读数 |
| 1 | 0.10 | 19.85 |
| 2 | 0.12 | 21.32 |
| 3 | 1.05 | 20.70 |
| 4 | 0.16 | 19.88 |
则产品中乳酸亚铁晶体的纯度为_______(以质量分数表示)。














