-
25℃时,水的电离达到平衡:H2O⇌H++OH-;△H>0,下列叙述正确的是( )
A.向水中加入氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀H2SO4反应
B.Ba(OH)2•8H2O与NH4Cl反应
C.灼热的炭与CO2反应
D.甲烷在O2中的燃烧反应难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.用湿润的蓝色石蕊试纸检验氨气
B.蒸馏实验中,温度计水银球应位于蒸馏烧瓶支管口处
C.只用BaCl2溶液就可以鉴别SO42-和CO32-
D.在实验室里硅酸钠溶液存放在带玻璃塞的试剂瓶中难度: 中等查看答案及解析
-
下列物质中含原子个数最多是( )
A.0.4molO2
B.5.6LCO2(标准状况)
C.4℃时5.4mLH2O
D.10gNe难度: 中等查看答案及解析
-
对于反应2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O下列分析错误的是( )
A.该反应氧化剂是H2C2O4
B.反应中1mol MnO4-得到5NA个e-
C.还原性Mn2+<H2C2O4
D.MnSO4可以做该反应的催化剂难度: 中等查看答案及解析
-
在某无色强酸性溶液中,下列各组离子一定能大量共存的是( )
A.、Fe3+、C1O-、SCN-
B.Mg2+、Cu2+、、
C.Na+、K+、、
D.K+、A13+、、C1-
难度: 中等查看答案及解析
-
给试管中某红色溶液加热,溶液颜色逐渐变浅,则原溶液可能是( )
①滴有石蕊的NH4Cl溶液
②滴有石蕊的CO2溶液
③滴有石蕊的H2SO4溶液
④滴有酚酞的氨水溶液
⑤滴有酚酞的氢氧化钠溶液
⑥滴有酚酞的Na2CO3溶液
⑦溶有SO2的品红溶液.
A.②④
B.①③⑤
C.①④⑥⑦
D.②④⑦难度: 中等查看答案及解析
-
在100mL某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入 1.92g铜粉,微热,充分反应后溶液中c(Cu2+)为( )
A.0.15mol/L
B.0.3mol/L
C.0.225mol/L
D.无法计算难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4
B.澄清的石灰水跟盐酸反应H++OH-═H2O
C.碳酸钙溶于醋酸CaCO3+2H+═Ca2++H2O+CO2↑
D.金属钠跟水反应2Na+2H2O═2Na++2OH-+H2↑难度: 中等查看答案及解析
-
Na2O2、Cl2、SO2等均能使品红溶液褪色.下列说法正确的是( )
A.Na2O2、Cl2、SO2依次属于电解质、非电解质、非电解质
B.标准状况下,1 mol Na2O2和22.4LSO2反应生成Na2SO4,转移电子2 mol
C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
D.在Na2O2中阴阳离子所含的电子数目不相等难度: 中等查看答案及解析
-
化学在日常生活和生产中有着重要的应用.下列说法不正确的有( )
①明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化;
②生活中常用苏打作发酵粉;
③氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;
④燃煤时加入适量石灰石,可减少废气中SO2的量;
⑤常温下浓硫酸可以用铁制容器盛放;
⑥工业上常用硅制造光导纤维.
A.1个
B.2个
C.3个
D.4个难度: 中等查看答案及解析
-
下列有关能量的判断或表示方法正确的是( )
A.从C(石墨)=C(金刚石)△H=+1.9kJ•mol-1,可知金刚石比石墨更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多
C.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.3 kJ
D.H2的燃烧热是△H=-285.8kJ/mol,则表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2 H2O(g)△H=-571.6 kJ•mol-1难度: 中等查看答案及解析
-
在2A(g)+B(g)⇌3C(g)+5D(g)反应中,表示该反应速率最快的是( )
A.υ(A)=2 mol/
B.υ(B)=0.3 mol/
C.υ(C)=0.8 mol/
D.υ(D)=1 mol/难度: 中等查看答案及解析
-
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
a b c d ① Si SiO2 H2SiO3 Na2SiO3 ② Al AlCl3 NaAlO2 Al(OH)3 ③ Cu CuO Cu(OH)2 CuSO4 ④ Na NaOH Na2CO3 NaHCO3 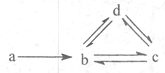
A.①②
B.②③
C.③④
D.②④难度: 中等查看答案及解析
-
关于下列各实验装置的叙述中,不正确的是( )
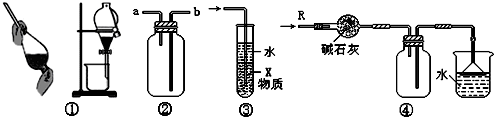
A.装置①可用于分离C2H5OH和H2O的混合物
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3难度: 中等查看答案及解析
-
对于可逆反应2AB3(g)⇌A2(g)+3B2(g)△H>0 (图中AB3%为体系中AB3的体积百分含量,v为反应速率).关于该可逆反应的下列图象不正确的是( )
A.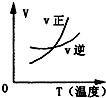
B.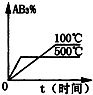
C.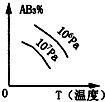
D.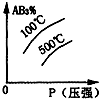
难度: 中等查看答案及解析
-
以下溶液混合呈中性的是( )
A.等体积等浓度的盐酸与氨水
B.等体积等浓度的硫酸与氢氧化钡
C.等体积等浓度的醋酸与氢氧化钠
D.等体积等浓度的硫酸与氢氧化钠难度: 中等查看答案及解析
-
常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D.0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)难度: 中等查看答案及解析
-
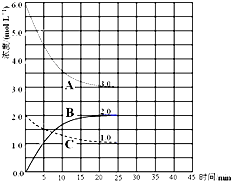
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
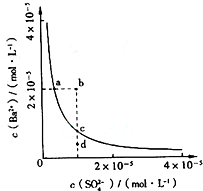
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp难度: 中等查看答案及解析
-
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色.W、Z同主族,Z的核电荷数是W的2倍.工业上一般通过电解氧化物的方法获得Y的单质.五种元素原子最外层电子数之和为20.则下列说法不正确的是( )
A.原子半径:X>Y>Q>W
B.Q和W可形成原子个数比为1:1和1:2的化合物
C.Q和Z所形成的分子中,各原子均满足8电子的稳定结构
D.X、Y和W三种元素形成的化合物的水溶液呈酸性难度: 中等查看答案及解析
-
在一密闭容器中,反应 aA(气)⇌bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增加了
D.a>b难度: 中等查看答案及解析