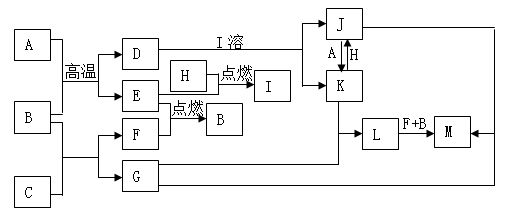
-
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用
②研发易降解的生物农药
③应用高效洁净的能源转换技术
④田间焚烧秸秆
⑤推广使用节能环保材料
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
难度: 简单查看答案及解析
-
下列工业上制备物质的过程中,无氧化还原反应发生的是( )
A.合成氨 B.从铝土矿中获得铝 C.玻璃制备 D.从海水中获得氯气
难度: 简单查看答案及解析
-
U是重要的核工业原料,在自然界的丰度很低。23592U的浓缩一直为国际社会关注。下列有关
U说法正确的是( )
A.
U原子核中含有92个中子
B.
U原子核外有143个电子
C.
U与
U互为同位素
D.
23592U与
U互为同素异形体
难度: 中等查看答案及解析
-
在无色透明碱性溶液中,能共存的离子组是( )
A.Na+、 CO32— 、SO42— 、Fe2+ B.MnO4— 、K+ 、SO42— 、Na+
C.K+、 SO42—、 HCO3—、Na+ D.Ba2+、 NO3— 、Cl—、 Na+
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是( )
A.铁与氯化铁溶液反应:Fe + Fe3+ ==2Fe2+
B.大理石与稀盐酸反应:CO
+ 2H+ ==CO2 ↑ + H2O
C.铜与稀硝酸反应:Cu + H+ + NO
==Cu2+ + NO↑ + H2O
D.氯气与氢氧化钠溶液反应:Cl2 + 2OH-==Cl-+ClO-+H2O
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.氯化钠的电子式
B.乙烯的结构式H-C=C-H
C.磷原子的结构示意图
D.乙酸的分子式C2H4O2
难度: 简单查看答案及解析
-
同分异构现象是造成有机物种类繁多的重要原因之一。下列各组物质中互为同分异构体的是( )
A.13C与14C B.CH3CH2OH与CH3COOH
C.甲烷与丙烷 D.
难度: 中等查看答案及解析
-
常温下,将下列物质溶于水中分别配制成0.1 mol•L—1溶液,所得溶液PH大于7的是( )
A.NaCl B.HCl C.NaOH D.CH3COOH
难度: 简单查看答案及解析
-
将铜纳米颗粒和银纳米颗粒相隔一定距离固定在石墨片上,然后浸在AgNO3溶液中,可构成一种纳米型原电池。该电池负极发生的反应为( )
A.Ag+ + e— ===Ag B.Cu — 2e— === Cu2+
C.Cu2+ + 2e— === Cu D.2H+ + 2e— === H2↑
难度: 中等查看答案及解析
-
下列反应结束后,向其中滴加KSCN溶液,溶液变成血红色的是( )
A.铁锈与过量稀盐酸 B.FeCl3溶液与过量铜片
C.FeCl3溶液与过量铁粉 D.FeCl2溶液与过量Zn粉
难度: 中等查看答案及解析
-
下列各组变化中,前者小于后者的是( )
① CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
② 2H2(g)+O2(g)═2H2O(l) ΔH1
H2(g)+O2(g)===H2O(l) ΔH2
③ t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时分别反应放出的热量
④ CaCO3(s)===CaO(s)+CO2(g) ΔH1
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2
A.①②③ B.②④ C.②③④ D.③④
难度: 困难查看答案及解析
-
下列反应中,属于氧化还原反应同时又是吸热反应的是( )
A.灼热的炭与CO2反应 B.铝与稀盐酸反应
C.Ba(OH)2·8H2O与NH4Cl反应 D.甲烷与O2的燃烧反应
难度: 简单查看答案及解析
-
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+
O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系

C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH=-452 kJ·mol-1
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为1.204×1024
难度: 困难查看答案及解析
-
在一定条件下,对于密闭容器中进行的反应:N2 (g) + 3H2 (g)
2NH3 (g),下列说法能充分说明该反应已经达到化学平衡状态的是( )
A.正、逆反应速率都等于零 B.N2、H2、NH3的浓度均不再变化
C.N2、H2、NH3在容器中共存 D.N2、H2、NH3的浓度相等
难度: 中等查看答案及解析
-
已知反应A2(g)+2B(s)
A2B2 (g) ΔH<0,下列说法正确的是( )
A.升高温度,化学平衡向正反应方向移动
B.增大压强,正反应与逆反应速率均增大
C.增大压强,化学平衡向正反应方向移动
D.增大B的物质的量,化学平衡向正反应方向移动
难度: 中等查看答案及解析
-
在密闭容器中进行反应:2SO2(g)+O2(g)
2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是( )
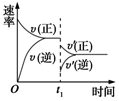
A.催化剂失效 B.减小生成物的浓度
C.降低体系温度 D.增大容器的体积
难度: 中等查看答案及解析
-
已知某可逆反应mA(g)+nB(g)
pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2,p1>p2,m+n>p,放热反应
B.T1>T2,p1<p2,m+n>p,吸热反应
C.T1<T2,p1>p2,m+n<p,放热反应
D.T1>T2,p1<p2,m+n<p,吸热反应
难度: 困难查看答案及解析
-
关于水的离子积常数,下列说法不正确的是( )
A.100 ℃水中,c(H+)·c(OH-)=1×10-14
B.纯水中,25 ℃时,c(H+)·c(OH-)=1×10-14
C.25 ℃时,任何以水为溶剂的稀溶液中c(H+)·c(OH-)=1×10-14
D.KW值随温度升高而增大
难度: 中等查看答案及解析
-
下列各电离方程式中,书写正确的是( )
A.H2S
2H++S2— B.KHSO4
K++H++SO
C.Al(OH)3
Al3++3OH— D.NaH2PO4
Na++H2PO
难度: 中等查看答案及解析
-
一定温度下,满足下列条件的溶液一定呈酸性的是( )
A.能与金属Al反应放出H2的溶液 B.加酚酞后显无色的溶液
C.pH=6的某溶液 D.c(H+)>c(OH-)的任意水溶液
难度: 中等查看答案及解析
-
下列实验操作和数据记录都正确的是( )
A.用托盘天平称量时,将NaOH固体放在右盘内的纸上,称得质量为10.2 g
B.用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL
C.用干燥的广泛pH试纸测稀盐酸的pH=3.2
D.用10 mL量筒量取NaCl溶液,体积为9.2 mL
难度: 中等查看答案及解析
-
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
选项
A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H3PO4
Fe(OH)3
非电解质
蔗糖
BaSO4
酒精
H2O
难度: 中等查看答案及解析
-
下表是常温下某些一元弱酸的电离常数:
弱酸
HCN
HF
CH3COOH
HNO2
电离常数
4.9×10-10
7.2×10-4
1.8×10-5
6.4×10-6
则0.1 mol·L-1的下列溶液中,pH最小的是( )
A.HCN B.HF C.CH3COOH D.HNO2
难度: 中等查看答案及解析
-
pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积的关系如图,下列说法正确的是( )

①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A.①④ B.②③ C.①③ D.②④
难度: 困难查看答案及解析
-
下图是用未知浓度的NaOH溶液来滴定10 mL盐酸(标准液)所得的曲线(25 ℃),则下列说法不正确的是( )
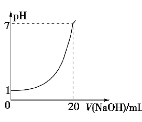
A.标准液盐酸的浓度为0.1 mol/L
B.NaOH溶液的浓度为0.05 mol/L
C.滴定终点时,俯视碱式滴定管读数,所测NaOH溶液浓度会偏高
D.指示剂变色时,说明盐酸与NaOH恰好完全反应
难度: 困难查看答案及解析