-
下列有关能源的叙述正确的是( )
A. 水力、电力、风力属一次能源 B. 氢能源、电力属二次能源
C. 汽油、酒精属一次能源 D. 石油、煤属二次能源
难度: 简单查看答案及解析
-
下列说法正确的是
①需要加热才能发生的反应一定是吸热反应
②放热的反应在常温下一定很容易发生
③反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
④放热反应加热到一定温度引发后,停止加热反应也能继续进行.
A. 只有①② B. 只有③④ C. ②③④ D. ①②③④
难度: 简单查看答案及解析
-
某同学在试管中做铁钉与稀硫酸反应的实验,发现反应速率较慢,下列措施:①给试管加热 ②加入铁粉 ③加入冰块 ④加入少量醋酸钠晶体 ⑤将稀硫酸换为浓硫酸,能加快反应速率的是
A. ①② B. ①②⑤ C. ③④ D. ①④⑤
难度: 简单查看答案及解析
-
美国研究人员将 CO 和氧原子附着在一种铁催化剂表面,用激光脉冲将其加热到 2000K,成功观察到CO 与氧原子形成化学键生成CO2的全过程。下列说法正确的是( )
A. CO、CO2均属于酸性氧化物
B. O2断键形成氧原子时需放出能量
C. CO 与氧原子形成化学键生成CO2 需要吸收能量
D. CO 与氧原子形成化学键过程中有电子转移
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 离子化合物一定不含共价键
B. 共价化合物中一定不含有离子键
C. 气态单质的分子中一定存在共价键
D. 非金属元素的化合物中一定不含离子键
难度: 简单查看答案及解析
-
13C−NMR(核磁共振)、15N−NMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获诺贝尔化学奖。下面有关叙述正确的是
A. 15N的核外电子数比中子数少1 B. 14N与14C互为同位素
C. 15N与14N 为同一种核素 D. 13C与15N有相同的中子数
难度: 简单查看答案及解析
-
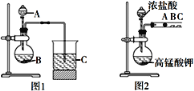
把下列物质分别加入盛水的锥形瓶,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如如图所示变化( )
① NH4NO3晶体 ② 浓H2SO4 ③ NaOH粉末
④ NaCl晶体 ⑤ Na2O2固体 ⑥ 生石灰
A. ①②④⑤ B. ①②③
C. ③④⑤ D. ②③⑤⑥
难度: 简单查看答案及解析
-
下列表示物质结构的化学用语正确的是( )
A. H2O2的电子式:
B. NaHCO3的电离:NaHCO3===Na+ + H+ +
C. 12C和14C的原子结构示意图均可表示为
D. 质子数为8,中子数为10的氧原子:
难度: 中等查看答案及解析
-
核内中子数为N的R2+离子,质量数为A,则n克它的氧化物中所含质子数的物质的量是( )
A.
mol B.
mol
C. (A−N+2)mol D.
(A−N+6)mol
难度: 简单查看答案及解析
-
化学反应A+B―→C(放出能量)分两步进行:①A+B―→X(吸收能量),②X―→C(放出能量)。下列示意图中表示总反应过程中能量变化的是( )
A.
 B.
B. 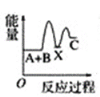 C.
C. 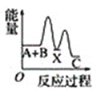 D.
D. 
难度: 中等查看答案及解析
-
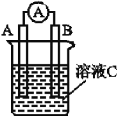
化学能可与热能、电能等相互转化。下列表述不正确的是( )
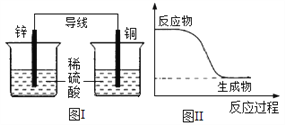
A. 化学反应中能量变化的主要原因是化学键的断裂与形成
B. 能量变化是化学反应的基本特征之一
C. 图I所示的装置能将化学能转变为电能
D. 图II所示的反应为放热反应
难度: 简单查看答案及解析
-
在研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量变化。据此判断,以下叙述中错误的是( )
A. 金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低
B. 物质燃烧可看成“ 储存” 在物质内部的能量(化学能)转化为热能释放出来
C. 当断开旧键吸收的能量大于形成新键释放的总能量时,该反应为吸收能量的反应
D. 反应物的总能量低于生成物的总能量时,则反应释放能量
难度: 中等查看答案及解析
-
微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为Zn+2OH−−2e−===Zn(OH)2,Ag2O+H2O+2e−===2Ag+2OH−。下列叙述中正确的是( )
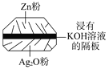
A. 在使用过程中,电解质KOH不断被消耗
B. 使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn电极发生还原反应,Ag2O电极发生氧化反应
D. Zn是负极,Ag2O是正极
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A. 放电时负极反应为Zn-2e-+2OH-===Zn(OH)2
B. 放电时正极反应为FeO42-+4H2O+3e-===Fe(OH)3+5OH-
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
难度: 中等查看答案及解析
-
在温度不变的条件下,在恒容容器中进行下列反应:N2O4(g)===2NO2(g),若N2O4的浓度由0.1 mol·L−1降到0.07 mol·L−1需要15 s,那么N2O4的浓度由0.07 mol·L−1降到0.05 mol·L-11所需的反应时间( )
A. 等于5 s B. 等于10 s
C. 小于10 s D. 大于10 s
难度: 简单查看答案及解析
-
向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )
甲:在500 ℃时,10 mol SO2和5 mol O2反应
乙:在500 ℃时,用V2O5作催化剂,10 mol SO2和5 mol O2反应
丙:在450 ℃时,8 mol SO2和5 mol O2反应
丁:在500 ℃时,8 mol SO2和5 mol O2反应
A. 甲、乙、丙、丁 B. 乙、甲、丙、丁
C. 乙、甲、丁、丙 D. 丁、丙、乙、甲
难度: 中等查看答案及解析
-
在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)
2Z(g),此反应达到平衡的标志是( )
A. 单位时间内消耗0.1 mol X的同时生成0.2 mol Z
B. v正(X) =v逆(Z)
C. 容器内X、Y、Z的浓度之比为1∶2∶2
D. 容器内压强不随时间变化
难度: 中等查看答案及解析
-
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
A. x =1
B. 2 min时,A的浓度为0.9mol·L-1
C. 2 min内A的反应速率为0.3 mol·L-1·min-1
D. B的转化率为60%
难度: 困难查看答案及解析