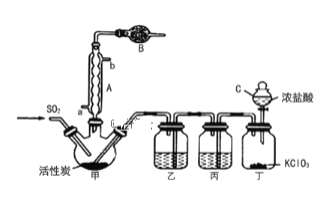
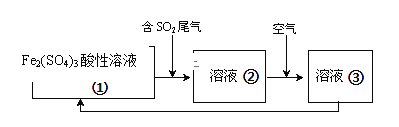
-
化学与生产、生活、科技、环境等密切相关。下列说法正确的是
A. 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3
B. 《抱朴子》中“以曾青涂铁,铁赤色如铜,“曾青”是可溶性铁盐
C. 高铁“复兴号”车厢连接关键部位使用的增强聚四氟乙烯板属于无机高分子材料
D. “华为麒麟980”手机中芯片的主要成分是二氧化硅
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法不正确的是
A.28g 乙烯和丙烯混合物中的极性键数目为4NA
B.32g Cu和32g S 充分反应,转移电子数为NA
C.精炼铜时,若阳极失去0.1 NA 个电子,则阴极增重3.2g
D.等物质的量的钠分别在足量的氧气和氯气中燃烧,转移电子数相等
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.等物质的量的NO和NO2同时被NaOH溶液吸收:NO + NO2 +2OH-= 2NO2-+H2O
B.等物质的量的MgCl2、Ba(OH)2和 HCl 溶液混合:Mg2++3OH﹣+H+=Mg(OH)2↓+H2O
C.Fe与过量稀硝酸的反应:Fe + 4H+ + NO3‾ = Fe2+ + NO↑+ 2H2O
D.碳酸钡溶于醋酸:BaCO3 + 2H+ = Ba2+ + H2O + CO2↑
难度: 中等查看答案及解析
-
下列实验操作所得的现象及结论均正确的是
实验操作
现象及结论
A
将AlC13溶液加热蒸干
得到白色固体,成分为纯净的AlC13
B
将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液
有白色沉淀产生,则Na2SO3已变质
C
向Na2SiO3溶液中通入CO2
有白色沉淀产生,则碳酸的酸性比硅酸强
D
向FeI2溶液中通入少量C12
溶液变黄,则C12的氧化性强于Fe3+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。该电池是以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液,其总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是( )
A.Zn为电池的正极
B.充电时阳极反应为:Fe(OH)3-3e+5OH =FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.该电池放电过程中电解质溶液浓度不变
难度: 中等查看答案及解析
-
下列叙述正确的是
A.使用催化剂能够降低化学反应的反应热(△H)
B.用向上排空气法收集铜粉与稀硝酸反应产生的NO
C.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
D.电镀时,待镀的金属制品表面发生还原反应
难度: 中等查看答案及解析
-
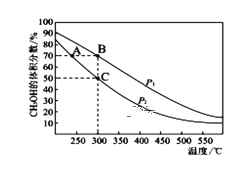
利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=﹣58kJ.mol﹣1,
②CO(g)+2H2(g)⇌CH3OH(g) △H2
③CO2(g)+H2(g)⇌CO(g)+H2O(g) △H3,
已知反应中一些相关物质的化学键键能数据如下:
化学键
C﹣O
C﹣H
H﹣H
H﹣O
C≡O
E/(kJ·mol﹣1)
343
413
436
465
1076
则△H2和△H3分别为
A.-99kJ·mol﹣1,+41kJ·mol﹣1
B.-99kJ·mol﹣1,-41kJ·mol﹣1
C.+99kJ·mol﹣1,-41kJ·mol﹣1
D.+99kJ·mol﹣1,+41kJ·mol﹣1
难度: 中等查看答案及解析