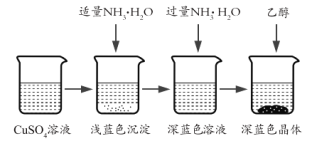
-
下列各组离子在指定溶液中能大量共存的是( )
A. 食盐水中:Fe2+、NH4+、Cl-、SO42- B. 氯化铁溶液中:Mg2+、K+、Cl-、SCN-
C. 苏打溶液中:Ca2+、Al3+、Cl-、NO3- D. 白醋中:K+、Na+、CO32-、SO42-
难度: 中等查看答案及解析
-
现代社会的发展与进步离不开材料,下列有关材料的说法不正确的是( )
A.港珠澳大桥路面使用了沥青和混凝土,沥青可以通过石油分馏得到
B.用于新版人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质
C.500米口径球面射电望远镜被誉为“中国天眼”,其“眼眶”是钢铁结成的圈梁,属于新型纯金属材料
D.国庆阅兵仪式上的坦克和军车都喷涂着新式聚氨酯迷彩伪装涂料,能适应多种环境背景下的隐蔽需求,聚氨酯属于有机高分子材料
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的有( )
①二氧化硅的分子式:SiO2 ②乙醛的结构简式:CH3CHO
③N2的结构式:N≡N ④中子数为18的氯原子:
⑤Na+的结构示意图:
⑥氯化铵的电子式:
A.5个 B.4个 C.3个 D.2个
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C
Na2S+2CO2↑。下列有关说法正确的是( )
A.1mol/L Na2SO4溶液液中含氧原子的数目一定大了4NA
B.1L 0.1mol/L Na2S溶液中含阴离子的数目小于0.1NA
C.生成1mol氧化产物时转移电子数为4NA
D.通常状况下11.2L CO2中含质子的数目为11NA
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4
CaCO3+SO42−
B.酸化NaIO3和NaI的混合溶液:I− +IO3−+6H+=I2+3H2O
C.KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)3=2FeO42−+3Cl−+4H++H2O
D.电解饱和食盐水:2Cl−+2H+
Cl2↑+ H2↑
难度: 中等查看答案及解析
-
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如下所示。
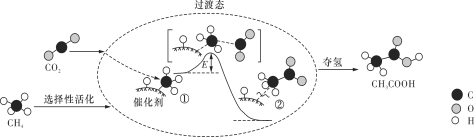
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C—H键发生断裂
C. ①→②放出能量并形成了C—C键
D. 该催化剂可有效提高反应物的平衡转化率
难度: 中等查看答案及解析
-
2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,共118种元素。短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。
下列说法不正确的是
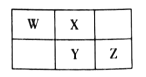
A.最高价氧化物对应水化物的酸性:Z>Y
B.W的氢化物与Z的氢化物反应,产物的水溶液呈碱性
C.在元素周期表中,117号元素与Z元素位于同一主族
D.工业上常用YX2漂白纸浆、毛、丝等
难度: 中等查看答案及解析
-
某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号
I
II
III
实验步骤
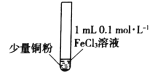
充分振荡,加入2mL蒸馏水
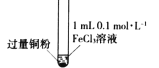
充分振荡,加入2mL蒸馏水
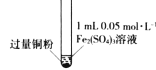
充分振荡,加入2mL蒸馏水
实验现象
铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象
铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀
铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀
下列说法不正确的是
A.实验I、II、III中均涉及Fe3+被还原
B.对比实验I、II说明白色沉淀的产生与铜粉的量有关
C.实验II、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
难度: 困难查看答案及解析
-
已知:同一个碳原子接两个羟基的分子不能稳定存在。某有机物分子式为C5H12O2,1mol该有物与钠完全反应生成22.4LH2(标况下),则其主链为4个碳原子的稳定存在的同分异构体有( )
A.7种 B.6种 C.5种 D.4种
难度: 困难查看答案及解析
-
下列实验操作、现象和结论均正确的是
实验操作
现象
结论
A
将少量某酸(HA)溶液滴入碳酸钠溶液中
无气泡
酸性:H2CO3>HA
B
将浸透石蜡油的石棉和碎瓷片放入硬质玻璃管,加强热,将生成的气体通入酸性高锰酸钾溶液
高锰酸钾溶液褪色
石蜡油裂解生成不饱和烃
C
向蔗糖溶液中加入稀硫酸并水浴加热,一段时间后再向混合液中加入新制Cu(OH)2悬浊液并煮沸
无砖红色沉淀
蔗糖未水解
D
在1mL相同浓度的碳酸钠和硫酸钠溶液中,分别滴加2滴0.1mo1/L AgNO3溶液
碳酸钠溶液中出现沉淀
Ksp(Ag2SO4)<
Ksp (Ag2CO3)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
某课题组以纳米Fe2O3 作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。以下说法正确的是( )
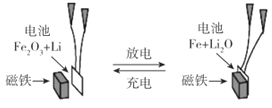
A.放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B.该电池可以用水溶液做电解质溶液
C.放电时,Fe作电池的负极,Fe2O3作电池的正极
D.充电时,电池被磁铁吸引
难度: 中等查看答案及解析
-
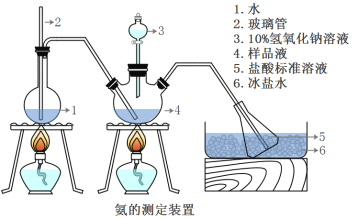
著名的“侯氏制碱法”主要反应原理是:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的Na2CO3,主要实验包括:制取NH3和CO2→生成NaHCO3→分离NaHCO3→制取Na2CO3 四个步骤。下列实验选用的主要仪器或主要步骤不正确的是
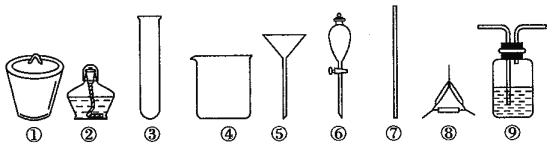
A.制取氨气,可选用②③
B.分离 NaHCO3,可选用④⑤⑦
C.制取 Na2CO3,可选用①②⑦⑧
D.制取 NaHCO3时,应先在⑨中通入CO2后再加入氨水
难度: 简单查看答案及解析
-
某化妆品的组分Z具有美白功效,其原料从杨树中提取,现可用如下反应制备:
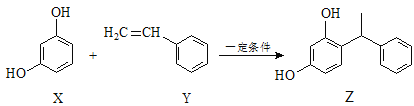
下列叙述正确的是( )
A.X、Y和Z均能使溴水褪色,且原理相同
B.X和Z均能与Na2CO3溶液反应放出CO2
C.Z中含手性碳原子
D.Y可作加聚反应的单体,X可作加聚反应的单体
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B.用排饱和氯化铵溶液的方法收集氨气
C.金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火
D.在4mL0.1mol·L-1的K2Cr2O7溶液中滴加数滴1mol·L-1的NaOH溶液,溶液颜色从橙色变成黄色
难度: 中等查看答案及解析
-
25 ℃时,向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图甲所示。NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图乙所示[其中a点的坐标为(9.5,0.5)]。
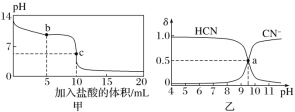
下列溶液中的关系一定正确的是( )
A.图乙中pH=7的溶液:c(Cl-)=c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-9.5
C.图甲中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图甲中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
难度: 中等查看答案及解析
-
练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:
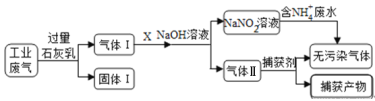
下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
难度: 中等查看答案及解析
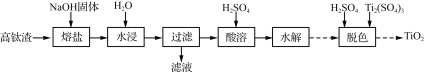
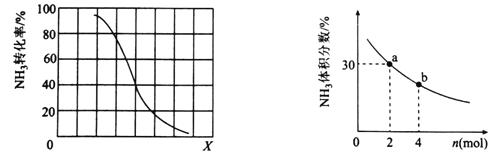
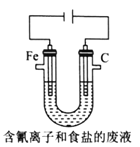
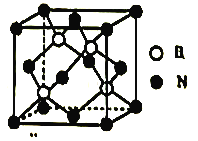
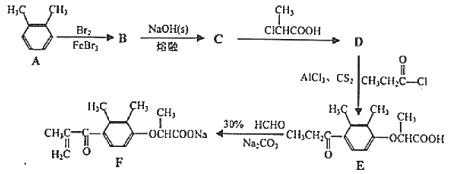
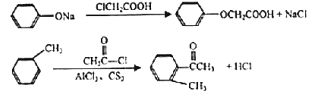
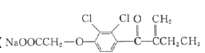 )是一种高效利尿药物,参考以上合成路线中的相关信息,设计以
)是一种高效利尿药物,参考以上合成路线中的相关信息,设计以