-
氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g)  2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)的△H=________________kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g)  HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________(填“温度”或“压强”)。
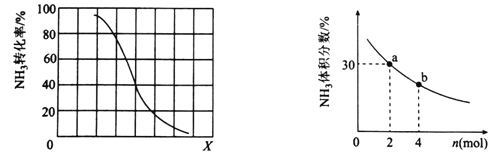
②其他条件一定,向2L密闭容器中加人 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________mol·L-1·min-1;平衡常数:K(a) ________K(b)(填“>”“=”或“<”)
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。
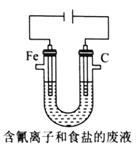
阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____CN-+ _____ClO-+ ________====_____CO32-+_____N2↑+________+________若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________L。
-
氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g)  2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)的△H=________________kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g)  HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________(填“温度”或“压强”)。
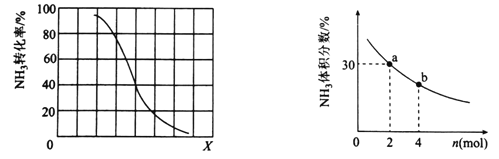
②其他条件一定,向2L密闭容器中加人 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________mol·L-1·min-1;平衡常数:K(a) ________K(b)(填“>”“=”或“<”)
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。
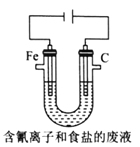
阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____CN-+ _____ClO-+ ________====_____CO32-+_____N2↑+________+________若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________L。
-
氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g)  2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)的△H=________________kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g)  HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________(填“温度”或“压强”)。
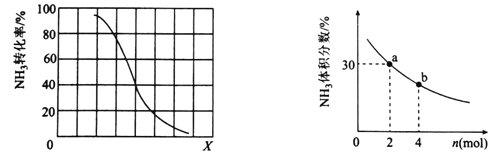
②其他条件一定,向2L密闭容器中加人 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________mol·L-1·min-1;平衡常数:K(a) ________K(b)(填“>”“=”或“<”)
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。
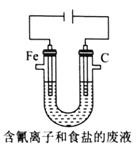
阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____CN-+ _____ClO-+ ________====_____CO32-+_____N2↑+________+________若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________L。
-
氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g)  2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)的△H=________________kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g)  HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________(填“温度”或“压强”)。
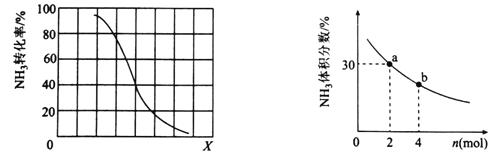
②其他条件一定,向2L密闭容器中加人 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________mol·L-1·min-1;平衡常数:K(a) ________K(b)(填“>”“=”或“<”)
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。
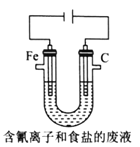
阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____CN-+ _____ClO-+ ________====_____CO32-+_____N2↑+________+________若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________L。
-
氨是一种重要的化工原料,可以用来制备氮化硅 、肼
、肼 、氢氰酸
、氢氰酸 。
。
(1)已知:




则反应 的
的 ________
________ 用a、b、c、d表示
用a、b、c、d表示 。
。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知 水解的方程式为:
水解的方程式为: 。常温下,该水解反应的平衡常数为
。常温下,该水解反应的平衡常数为 ,则
,则 溶液的
溶液的 ________。
________。
(3)工业上利用氨气生产氢氰酸 的反应为:
的反应为:
①其他条件一定,达到平衡时, 转化率随外界条件X变化的关系如图1所示。X代表的是________
转化率随外界条件X变化的关系如图1所示。X代表的是________ 填“温度”或“压强”
填“温度”或“压强” 。
。
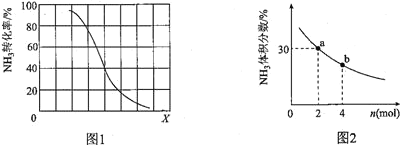
②其他条件一定,向 密闭容器中加入
密闭容器中加入 和
和 ,平衡时,
,平衡时, 体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为
体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为 ,该时间段内用
,该时间段内用 的浓度变化表示的反应速率为________
的浓度变化表示的反应速率为________ ;平衡常数:
;平衡常数: ________
________ 填“
填“ ”“
”“ ”或“
”或“ ”
” 。
。
③工业上用电解法处理含氰电镀废水 的装置如图所示。
的装置如图所示。
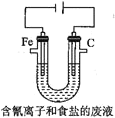
阳极产生的氯气与碱性溶液反应生成 ,
, 将
将 氧化的离子方程式为:__________________________________________________________若电解处理
氧化的离子方程式为:__________________________________________________________若电解处理 ,则阴极产生气体的体积
,则阴极产生气体的体积 标准状况下
标准状况下 为________L。
为________L。
-
“中国芯”的发展离不开单品硅,四氯化硅是制备高纯硅的原料、某小组拟在实验室用下列装置模拟探究四氯化的制备和应用(夹持装置已省略)。
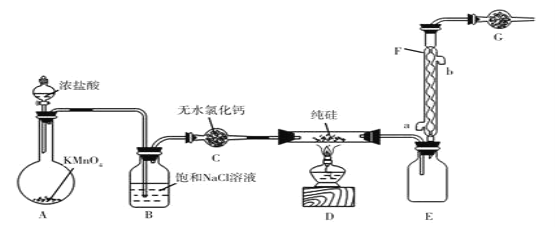
已知有关信息:
①Si+3HCl SiHCl3+H2,Si+2Cl2
SiHCl3+H2,Si+2Cl2 SiCl4
SiCl4
②SiCl4遇水剧烈水解,SiCl4的熔点、沸点分别为-70.0℃、57.7℃
请回答下列问题
(1)装浓盐酸的仪器名称是________________。
(2)写出A中发生反应的离子方程式________________。
(3)若拆去B装置,可能的后果是________________(写出一个即可)。
(4)有同学最初将E、F、G装置设计成图Ⅱ装置,图Ⅱ装置的主要缺点是________________。(写出一个即可)

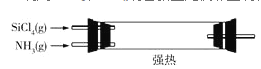
(5)已知NH4Cl在高温条件下易分解生成NH3和HCl。利用SiCl4和NH3制备新型无机非金属材料(Si3N4)的装置如图III。写出该反应的化学方程式:________________利用尾气制备盐酸,宜选择下列装置中的________________(填字母)。
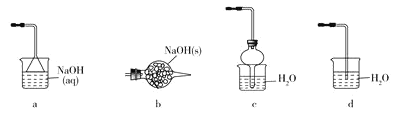
(6)取少量SiCl4产品溶于足量蒸馏水中生成硅酸,该反应的化学方程式为________________。
-
下列说法不正确的是
A. SiO2能与HF反应,因此可用HF刻蚀玻璃
B. 向Na2SiO3溶液中逐滴加入稀盐酸制备硅酸凝胶
C. 氮化硅是一种重要的结构陶瓷材料,化学式为Si3N4
D. 石英是良好的半导体材料,可以制成光电池,将光能直接转化成电能
-
氰化氢(HCN) 是形成生物重要化合物的重要源或中间体,其水溶液称氢氰酸,是一种非常弱的酸。工业上以甲烷和氨气为原料在高温和催化剂的作用下按下列反应制备HCN:
2CH4(g)+3O2(g)+2NH3(g) 2HCN(g)+6H2O(g) △H1=-475kJ/mol①
2HCN(g)+6H2O(g) △H1=-475kJ/mol①
CH4(g)+NH3(g) HCN(g)+3H2(g) △H2= +240kJ/mol②
HCN(g)+3H2(g) △H2= +240kJ/mol②
(1)该条件下1mol 水蒸气分解为氢气和氧气的热化学方程式为________________________(数值保留三位有效数字)。根据题中信息_______________(填“能”或“不能”)计算出氢气的燃烧热。
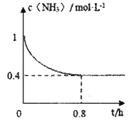
(2)在恒温恒容的密闭容器中按照体积比6:5 的比例充入甲烷和氨气发生反应②,氨气的物质的量浓度与时间关系如图所示,从开始到0.8h达平衡状态的过程中v(H2)=____________________;甲烷的平衡转化率为____________;该温度下反应②的平衡常数K=________________________。
(3)工业生产中反应②常用铂作催化剂,甲、乙两名同学在讨论催化剂的选择,甲同学认为用铂作催化剂会提高生产成本,应研究出更廉价的催化剂;乙同学认为使用铂不会明显提高生产成本。你认为观点更合理的是___________(填“甲”或“乙”),原因是______________________________。
(4)HCN及其盐均有剧毒,因此含CN-的工业废水必须经过处理才能排放,处理方法之一是电解氧化法;以石墨为阳极、铁板为阴极电解含CN-的碱性废水,将CN-转化为N2和CO2。该方法的阳极反应式为___________________________。为确保CN-被完全处理掉,电解一段时间后通常会加入适量氯化钠固体,其作用可能是_____________________________。
-
氮化硅是一种重要的结构陶瓷材料,它是一种超硬物质,本身具有润滑性,并且耐磨损。一定条件下,氮气、氢气与四氯化硅反应可以制得氮化硅,化学反应方程式为:3SiCl4+6H2+2N2 → Si3N4+12HCl
氮的氢化物肼(N2H4)是航天火箭发射常用的燃料,二氧化氮作氧化剂。
回答以下问题:
(1)氮原子的最外层电子排布式是_________________;氮元素有多种化合价,写出含2种价态氮的化合物的化学式_________________(举一例)。
(2)硅原子核外电子排布在______________种不同能量的电子亚层上,氮化硅属______________晶体。
(3)上述反应中,属于同一周期的元素符号有_________,用___________________________事实可以比较它们的非金属性强弱。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。NH3分子的空间构型是______________;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是_________(举一例)。
(5)肼作火箭发射燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l) → 3N2(g)+4H2O(g)+1038.7kJ若该反应中有4mol N-H键断裂,则形成的气体有_____mol,其中转移电子数目_____。
(6)肼能与硫酸反应生成N2H6SO4。该物质晶体类型与硫酸铵相同,则其溶液PH_______7(填>、<或=),原因是____________________(用离子方程式表示)
-
用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)=Si3N4(s)+12HCl(g) △H<0 ,一定条件下,在密闭恒容的容器中,能发生上述反应达到化学平衡状态的是
A. 3v(正)(N2)= v(正)(H2) B. v(正)(HCl)=4 v(正)(SiCl4)
C. 混合气体密度保持不变 D. c(N2):c(H2):c(HCl)=1:3:6
2NH3(g) △H2=bkJ·mol-1
HCN(g)+3H2 (g) △H>O








 的
的





