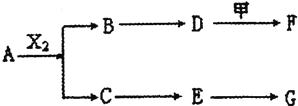-
如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )
A.气态氢化物稳定性:R>Q
B.元素T的离子半径>元素R的离子半径
C.与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键
D.Q可形成多种同分异构体
难度: 中等查看答案及解析
-
下列各组元素性质的递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多 B.N、O、F电负性依次增大
C.P、S、Cl元素最高正价依次升高 D.Na、K、Rb第一电离能逐渐增大
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其中Y与Z为金属元素,四种元素的简单离子的电子层结构均相同。p、q是它们中的部分元素组成的化合物,r是W的单质,s是Z的单质。这些物质间的转化关系如图所示。下列说法不正确的是
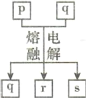
A.原子半径:Y>Z>W>X
B.q属于离子化合物
C.一定条件下,r与s能发生化合反应生成p
D.p能与盐酸反应,但不能与氢氧化钠溶液反应
难度: 中等查看答案及解析
-
下列关于物质性质变化的比较,不正确的是( )
A.酸性强弱:HI>HBr>HCl>HF
B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH
D.还原性强弱:F->Cl->I-
难度: 中等查看答案及解析
-
下列关于周期表的说法正确的是( )
A.C和Si属于第ⅣA族元素,SiH4比CH4稳定
B.N和B属于第二周期元素,原子半径:N>B
C.S和Cl属于第三周期元素,其含氧酸的酸性:H2SO4<HClO3
D.某元素氢化物的化学式为RH3,则其最高价氧化物的水化物可能为HRO3
难度: 中等查看答案及解析
-
X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
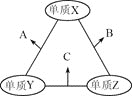
A.X元素位于第ⅥA族
B.A不能溶解于B中
C.A和C不可能发生氧化还原反应
D.B的沸点高于C的沸点
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径:r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是( )
A.元素Z、W的简单离子的电子层结构不同
B.元素Y的简单气态氢化物的热稳定性比Z的强
C.仅由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性
D.化合物X2Z2与W2Z2所含化学键类型完全相同
难度: 困难查看答案及解析
-
下列关于第三周期主族元素的递变关系错误的是( )
A.最外层电子数逐渐增多 B.原子半径逐渐增大
C.最高正价数值逐渐增大 D.从硅到氯最低负价从-4→-1
难度: 简单查看答案及解析
-
同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4,下列判断正确的是( )
①阴离子的还原性按X、Y、Z顺序减弱 ②单质的氧化性按X、Y、Z顺序增强 ③元素的原子半径按X、Y、Z顺序减小 ④气态氢化物的稳定性按X、Y、Z顺序减弱
A.①② B.②③ C.①②③ D.①②③④
难度: 中等查看答案及解析
-
短周期元素a、b、c、d的原子序数依次增大。a、b能组成常温下呈液态的两种常见化合物。b和d位于同主族。已知:a2b和c2d3混合发生剧烈反应生成白色沉淀和无色气体。下列说法正确的是
A.气态氢化物稳定性:d>b B.原子半径:d>c>b>a
C.a2db3化合物能促进水电离 D.工业上电解熔融c2b3冶炼c单质
难度: 中等查看答案及解析
-
下列说法正确的是
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.同周期非金属氧化物对应水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
难度: 中等查看答案及解析
-
W、X、Y、Z四种元素是原子序数依次增大的短周期主族元素,已知:①四种元素的电子层数之和等于10,且它们是连续的四种主族元素;②四种元素的原子,其半径最大的是X原子。下列说法正确的是
A.W和X均位于第二周期 B.Y和Z分别是Al和Si
C.W和X分别是O和F D.Z的金属性可能比X强
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的四种短周期主族元素,W的原子半径是周期表中所有元素最小的,W、X同主族,X、Z同周期且X与Z最高正价之和等于8,Y的族序数等于其周期数。下列叙述错误的是
A.原子半径:X>Y>Z
B.X的简单离子与Z的简单离子具有相同的电子层结构
C.W与X形成的化合物与水反应时,水作氧化剂
D.X、Y、Z的最髙价氧化物对应的水化物两两之间均能发生反应
难度: 中等查看答案及解析
-
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是( )
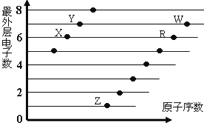
A. X与W形成的化合物中只有共价键
B. X与Z形成的化合物中只有离子键
C. 元素的非金属性:X>R>W
D. 简单离子的半径:W>R>X
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是
A.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
B.元素W的最高价氧化物对应的水化物酸性比Q的强
C.元素X与元素Z的最高正化合价之和的数值等于8
D.离子Y2-和Z3+的核外电子数和电子层数都不相同
难度: 中等查看答案及解析
-
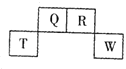
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等。下列判断不正确的是
A
B
C
D
A.最简单气态氢化物的热稳定性:A>C
B.最高价氧化物对应水化物的酸性:C<D
C.原子半径:B>C>A
D.含B元素的盐溶液一定显酸性
难度: 中等查看答案及解析
-
下列关于ⅦA族元素的叙述正确的是
A.ⅦA族元素是同周期中原子半径最大的元素(惰性气体元素除外)
B.ⅦA族元素是同周期中非金属性最弱的元素
C.ⅦA族元素的最高正价都是+7价
D.ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法错误的是( )
Y
M
X
Z
A.钠与Z可能形成Na2Z2化合物
B.由X与氧组成的物质在熔融时能导电
C.Y的最简单气态氢化物的热稳定性比X的强
D.M的简单离子半径是同周期中简单离子半径最小的
难度: 中等查看答案及解析
-
下列各组元素性质或原子结构递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的电子层数依次增多
难度: 简单查看答案及解析
-
已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数c>b B.离子的还原性Z->Y2-
C.氢化物的稳定性H2Y>HZ D.原子半径X>W
难度: 中等查看答案及解析