-
用标准浓度的NaOH溶液滴定未知浓度的盐酸时下列情况会使盐酸物质的量浓度偏低的是( )
A. 碱式滴定管用蒸馏水洗净后,直接注入标准浓度的NaOH溶液
B. 碱式滴定管尖端有气泡,滴定后气泡消失
C. 记录消耗的碱液,滴定前平视,滴定后俯视凹液面
D. 锥形瓶用蒸馏水洗净后,直接装入未知浓度的盐酸
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
难度: 中等查看答案及解析
-
实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜的试剂是
A.NaOH溶液 B.氨水 C.盐酸 D.Ba(OH)2溶液
难度: 中等查看答案及解析
-
据报道,近来发现了一种新的星际分子氰基辛炔,其结构简式为HC≡C—C≡C—C≡C—C≡C—C≡N。下列对该物质的判断正确的是( )
A.属于不饱和烃 B.不能使酸性KMnO4溶液褪色
C.所有原子都在同一条直线上 D.可由乙炔和含氮化合物加聚制得
难度: 中等查看答案及解析
-
下列做法中用到物质氧化性的是
A.明矾净化水 B.臭氧消毒餐具
C.纯碱除去油污 D.食醋清洗水垢
难度: 简单查看答案及解析
-
在温度不变的条件下,密闭容器中发生如下反应:2SO2+O2
2SO3,下列叙述能够说明反应已经达到平衡状态的是( )
A.容器中SO2、O2、SO3共存
B.SO2与SO3的浓度相等
C.容器中SO2、O2、SO3的物质的量之比为2∶1∶2
D.反应容器中压强不随时间变化
难度: 中等查看答案及解析
-
能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的操作是( )
A.向水中投入一小块金属钠 B.加入NaHCO3固体
C.向水中加入CH3COONa晶体 D.向水中加入NH4Cl溶液
难度: 简单查看答案及解析
-
在恒温条件下,欲使CH3COONa的稀溶液中
比值增大,可在溶液中加入少量下列物质中的( )
①固体NaOH ②固体KOH ③固体NaHSO4 ④固体CH3COONa ⑤冰醋酸
A.只有①② B.只有③⑤ C.只有②④⑤ D.只有①⑤
难度: 简单查看答案及解析
-
反应2SO2(g)+O2(g)
2SO3(g),经一段时间后SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.4mol·L-1·min-1,则这段时间为
A.0.5s B.1s C.30s D.60s
难度: 简单查看答案及解析
-
下列4个化学反应中,与其他3个反应类型不同的是( )
A.CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
B.CH3CH2OH+CuO
CH3CHO+Cu+H2O
C.2CH2===CH2+O2
2CH3CHO
D.CH3CH2OH+HBr―→CH3CH2Br+H2O
难度: 中等查看答案及解析
-
在室温下,pH相同、体积相同的氨水和NaOH溶液,采取下列措施后,有关叙述正确的是( )
A.温度下降20 ℃,两溶液的pH均不变
B.各加水稀释10倍,两溶液的pH仍相等
C.分别加入适量的氯化铵晶体,两溶液的pH均减小
D.各用相同物质的量浓度的盐酸中和,所消耗盐酸的体积相等
难度: 中等查看答案及解析
-
用盐酸作标准液滴定待测浓度的NaOH溶液,若用甲基橙作指示剂,当滴定达终点时,溶液颜色变化是( )
A.由红色变橙色 B.由黄色变红色 C.由黄色变橙色 D.由橙色变黄色
难度: 简单查看答案及解析
-
下列醇类物质中,能被氧化成醛的是( )
A.CH3CH2CH2OH
B.
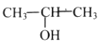
C.
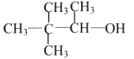
D.
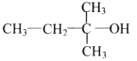
难度: 中等查看答案及解析
-
某有机化合物A的相对分子质量范围为100~130。经分析得知,其中碳和氢的质量分数之和为46.66%,其余为氧,则该化合物分子中最多含碳氧双键的个数为( )
A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A. 溶液中离子的数目减小
B. 再加入CH3COONa固体能促进醋酸的电离
C. 醋酸的电离程度增大,c(H+)亦增大
D. 溶液中c(CH3COO-)/c(CH3COOH)∙c(OH-)不变
难度: 中等查看答案及解析
-
在一定温度下,在一个密闭容器中加入H2和I2蒸气各0.5mol,发生反应H2+I2
2HI,达到平衡时,生成HI 0.8 mol,若其它条件不变,开始充入的H2为2 mol,则达到平衡时生成的HI可能是下列中的
A.1.1 mol B.0.87 mol C.0.8 mol D.0.5 mol
难度: 中等查看答案及解析
-
可以用来鉴别气态烷烃和烯烃,又可以用来除去烷烃中混有的少量烯烃的操作方法是( )
A.混合气通过盛CCl4的洗气瓶 B.混合气跟氯气混合
C.混合气通过盛水的洗气瓶 D.混合气通过盛足量溴水的洗气瓶
难度: 简单查看答案及解析
-
在容积为2 L的密闭容器中,有反应mA(g)+nB(g)
pC(g)+qD(g),经过5 min达到平衡,此时各物质的变化为A物质的量浓度减少amol·L-1,B的平均反应速率v(B)=a/15 mol·L-1·min-1,C物质的量浓度增加2a/3 mol·L-1,这时若增大系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
A.3∶1∶2∶2 B.1∶3∶2∶2 C.3∶1∶2∶1 D.1∶1∶1∶1
难度: 中等查看答案及解析
-
将0.2 mol·L-1的KOH溶液与0.1 mol·L-1的H2SO3溶液等体积混合后,溶液中各粒子浓度大小关系正确的是( )
A.c(K+)+c(H+)=c(OH-)+c(
)+c(
)
B.2c(K+)=c(
)+c(
)+c(H2SO3)
C.c(K+)>c(
)>c(
)>c(H2SO3)
D.c(
)+c(
)+c(H2SO3)=0.1 mol·L-1
难度: 中等查看答案及解析
-
反应CO(g)+2H2(g)
CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
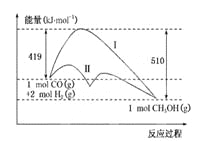
A.该反应的ΔH=+91 kJ/mol
B.加入催化剂,正、逆反应的活化能数值均减小
C.加入催化剂,该反应的ΔH变小
D.如果该反应生成液态CH3OH,则ΔH变大
难度: 中等查看答案及解析
-
杯环芳烃因其结构类似于酒杯而得名,其键线式如图,下列关于杯环芳烃的说法正确的是( )
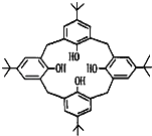
A.属于芳香烃 B.最多与6mol H2发生加成反应
C.分子式为C44H56O4 D.分子内所有原子一定在同一平面上
难度: 简单查看答案及解析
-
下列因素与可燃物燃烧的剧烈程度无关的是( )
A.可燃物本身是不是易燃 B.可燃物的着火点
C.周围氧气的浓度 D.可燃物与空气的接触面积
难度: 简单查看答案及解析
-
在一定温度下,向一个2 L的真空密闭容器中(预先装入催化剂)通入1 mol N2和3 mol H2,经过一段时间后,测得容器内压强是起始时的0.9倍。在此时间段内H2的平均反应速率为0.1 mol·L-1·min-1,则经过时间为( )
A. 2 min B. 3 min C. 4 min D. 5 min
难度: 简单查看答案及解析
-
盐类水解的过程中,下例说法错误的是( )
A.盐的电离平衡被破坏 B.水的电离平衡被破坏
C.溶液的pH发生改变 D.生成了弱电解质
难度: 简单查看答案及解析
-
有关下图所示化合物的说法不正确的是
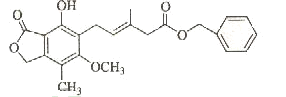
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1mol该化合物最多可以与3mol NaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
难度: 中等查看答案及解析
-
药皂具有杀菌、消毒作用,通常是因为在普通肥皂中加入了适量的( )
A.酒精 B.次氯酸 C.甲苯酚 D.过氧化钠
难度: 简单查看答案及解析
-
某石油化工产品X的转化关系如图,下列判断不正确的是( )
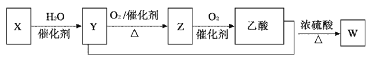
A. X可以发生加聚反应 B. Y能与钠反应产生氢气
C. Z与CH3OCH3互为同分异构体 D. W的结构简式为CH3COOC2H5
难度: 简单查看答案及解析
-
下列说法错误的是( )
A.钢铁发生析氢腐蚀时,负极电极反应是Fe-2e-===Fe2+
B.铜制品和钢铁制品一样能发生析氢腐蚀
C.常温下钢铁在浓硝酸溶液中不会发生析氢腐蚀
D.钢铁发生析氢腐蚀时,H+得电子释放出H2,钢铁被腐蚀
难度: 简单查看答案及解析
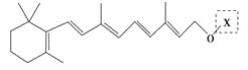
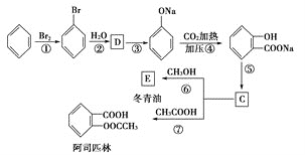
 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。