-
下列说法正确的是( )
A.洗涤油污常用热的碳酸钠溶液
B.用加热的方法可以除去KCl溶液中的Fe3+
C.配制FeSO4 溶液时,将FeSO4 固体溶于稀盐酸中,然后稀释至所需浓度
D.将AlCl3溶液和Na2SO3溶液分别加热蒸干、灼烧后,所得固体为Al2O3和Na2SO3
难度: 困难查看答案及解析
-
化学与生活、生产、科技密切相关。下列说法错误的是( )
A.碳酸钠溶液显碱性,可以用作厨房洗涤剂
B.明矾可用作净水剂
C.高铁酸钠具有强氧化性,可以用来对水消毒
D.SO2具有漂白性,可用于食品增白
难度: 中等查看答案及解析
-
在一氧化碳变换反应CO + H2O
CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
D.增大c(CO),活化分子百分数增大,有效碰撞几率增加
难度: 中等查看答案及解析
-
下列关于化学反应速率的说法正确的是 ( )
A. 升高温度可降低化学反应的活化能,使化学反应速率提高
B. 在温度、体积都相同的两容器中,分别充入相同物质的量的Br2和Cl2,让它们与等量的氢气发生反应,反应速率相同
C. 0.1 mol·L-1盐酸和0.1 mol·L-1硝酸与相同形状和大小的大理石反应的速率相同
D. 有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增加活化分子的百分数,从而使反应速率加快
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.pH=l的溶液中:Ba2+、Fe3+、Cl-、SCN-
B.能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32-
C.
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D.由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干均得不到原溶质
B.保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解
C.室温下,向0.1mol/L的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
难度: 中等查看答案及解析
-
利用固体表面催化工艺进行NO分解的过程如下图所示。

下列说法不正确的是
A.NO属于共价化合物
B.O2含有非极性共价键
C.过程②吸收能量,过程③释放能量
D.标准状况下,NO分解生成11.2LN2转移电子数为6.02×1023
难度: 中等查看答案及解析
-
下列四种溶液中,水的电离程度最大的是( )
A.pH=5的NH4Cl溶液 B.pH=5的NaHSO4溶液
C.pH=8的CH3COONa溶液 D.pH=8的NaOH溶液
难度: 简单查看答案及解析
-
偏二甲肼[(CH3)2N—NH2]与N2O4是常用的火箭推进剂,火箭发射时常出现红棕色气体,发生的化学反应如下:
① (CH3)2N—NH2(l) + 2N2O4(l) = 2CO2(g) + 3N2(g) + 4H2O(g) ∆H1<0
② N2O4(l)
2NO2(g) ∆H2 >0
下列说法不正确的是
A.反应①中,N2O4为氧化剂
B.反应①中,生成1mol CO2时,转移8 mol e-
C.由反应②推断:加压、降温是获得液态N2O4的条件
D.温度升高,反应①的化学反应速率减小、反应②的化学反应速率增大
难度: 中等查看答案及解析
-
今有室温下四种溶液,下列有关叙述不正确的是( )

A. ③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. V1 L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
难度: 困难查看答案及解析
-
可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9 mol2·L-2;Ksp(BaSO4)=1.1×10-10 mol2·L-2。下列推断正确的是( )
A. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B. 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C. 若误饮[Ba2+]=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D. 可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃
难度: 困难查看答案及解析
-
向三份0.1mol/LCH3COONa溶液中分别加入少量硫酸铵、碳酸钠、硫酸铝固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为:
A.减小、增大、增大 B.增大、减小、减小
C.减小、增大、减小 D.增大、增大、减小
难度: 简单查看答案及解析
-
某温度下,将pH和体积均相同的HCl和CH3COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
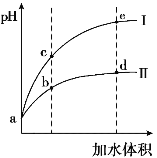
A.曲线II代表HCl的稀释过程
B.溶液中水的电离程度:b点>c点
C.从b点到d点,溶液中
保持不变
D.该温度下,b点Kw的数值比e点大
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A.Si
SiO2
H2SiO3 B.NH4Cl
NH3
(NH4)2SO4
C.N2
NO
HNO3 D.Fe2O3
FeCl3(aq)
FeCl3(s)
难度: 中等查看答案及解析
-
三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
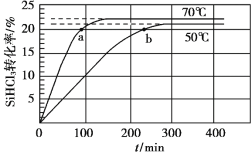
下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
难度: 中等查看答案及解析
-
常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
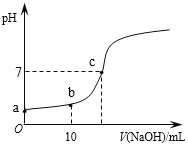
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中
的值不断增大
难度: 困难查看答案及解析