-
(1)已知碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11,草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
①0.1mol·L-1Na2CO3溶液的pH____0.1mol·L-1Na2C2O4溶液的pH。(填“大于”“小于”或“等于”)
②碳酸钠溶液显碱性的原因是_____________________________ 。(用主要的离子方程式表示)
③若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是______(填字母)。
a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
c.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
d.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
(2)用氨水除去SO2。
已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OH-)=________mol·L-1。将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的c(SO32-)/c(HSO3-)=__________。
高二化学填空题中等难度题查看答案及解析
-
碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11,草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5,将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是
A. c(H+)>c(HC2O4-)>c(HCO3-)>c(C2O42-)
B. c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C. c(H+)>c(HC2O4-)>c(C2O42-)>c(HCO3-)
D. c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
高二化学单选题中等难度题查看答案及解析
-
(1)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11;草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3 溶液的 pH________0.1 mol/L Na2C2O4 溶液的pH。(选填“大于”“小于”或“等于”)
等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
(2)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的 pH 变化不大,用平衡移动原理解释上述现象_________________________。
(3)请写出Na2CO3溶液中的微粒之间的关系式:
电荷守恒______________________,
质子守恒_______________________。
(4)已知 Ag2 CrO4、AgCl 的 Ksp 分别为 2.0×10-12和 2.0×10-10。在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与 CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中 Cl-恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,溶液中 c(Ag+)为____________mol·L-1,此时溶液中 c(CrO42-)等于__________mol·L-1。
高二化学填空题困难题查看答案及解析
-
(1)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
①0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”)
②若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
A.[H+]>[HC2O4-]>[HCO3-]>[CO32-] B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
C.[H+]>[HC2O4-]>[C2O42-]>[CO32-] D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
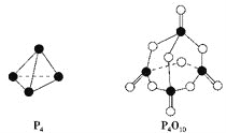
(2)白磷与氧气可发生如下反应:P4+5O2= P4O10。已知断裂下列化学键需要吸收的能量分别为: P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH=___________。
(3)25 ℃,某浓度的盐酸、氯化铵溶液中由水电离出的氢离子浓度分别为1.0×10-amol·L-1、1.0×10-b mol·L-1,这两种溶液的pH之和=___________。
(4)在t ℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示:
序号
氢氧化钡溶液
的体积/mL
盐酸的体积/mL
溶液的pH
①
22.00
0.00
8
②
22.00
18.00
7
③
22.00
22.00
6
假设溶液混合前后的体积变化忽略不计,则c=___________。
高二化学综合题中等难度题查看答案及解析
-
已知:25℃时,有关弱酸的电离平衡常数,下列选项中正确的是
弱酸
H2C2O4
CH3COOH
HCN
H2CO3
电离常数Ki
Ki1=5.9×l0-2
Ki2=6.4×l0-5
1.8×l0-5
4.9×l0-10
Ki1=4.3×l0-7
Ki2=5.6×l0-11
A.等物质的量浓度的溶液pH关系:NaHCO3>NaCN>CH3COONa>NaHC2O4
B.反应NaHC2O4+NaHCO3→Na2C2O4+H2O+CO2↑能发生
C.等体积等物质的量浓度的溶液中离子总数:NaCN>CH3COONa
D.Na2CO3溶液中2c(Na+)=c(CO32-)+c(HCO3-)+c( H2CO3)
高二化学选择题中等难度题查看答案及解析
-
已知:25℃时,有关弱酸的电离平衡常数,下列选项中正确的是
弱酸
H2C2O4
CH3COOH
HCN
H2CO3
电离常数Ki
Ki1=5.9×l0-2
Ki2=6.4×l0-5
1.8×l0-5
4.9×l0-10
Ki1=4.3×l0-7
Ki2=5.6×l0-11
A.等物质的量浓度的溶液pH关系:NaHCO3>NaCN>CH3COONa>NaHC2O4
B.反应NaHC2O4+NaHCO3→Na2C2O4+H2O+CO2↑能发生
C.等体积等物质的量浓度的溶液中离子总数:NaCN>CH3COONa
D.Na2CO3溶液中2c(Na+)=c(CO32-)+c(HCO3-)+c( H2CO3)
高二化学选择题中等难度题查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25 ℃)
Ki=1.77×10-4
Ki=4.9×10-10
Ki1=4.3×10-7
Ki2=5.6×10-11
下列选项错误的是( )
A.2CN-+H2O+CO2=2HCN+ CO32-
B.2HCOOH+ CO32-=2HCOO-+H2O+CO2↑
C.中和等体积
、等c(H+)的HCOOH和HCN消耗NaOH的量前者小于后者
D.相同物质的量浓度的HCOOH和HCN溶液中,c(
HCOO-)<c(CN-)
高二化学选择题中等难度题查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
Ki=1.77×10-4
Ki=4.9×10-10
Ki1=4.3×10-7 Ki2=5.6×10-11
下列选项错误的是
A.CN-+H2O+CO2=HCN+HCO3-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数后者大
高二化学选择题困难题查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25 ℃)
K1=1.77×10-4
K1=4.9×10-10
Ki1=4.3×10-7
Ki2=5.6×10-11
下列选项错误的是( )
A.2CN-+H2O+CO2 → 2HCN+CO32-
B.2HCOOH+CO32-→ 2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液pH前者小于后者
高二化学选择题困难题查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数
(25℃)
Ki=1.77×10-4
Ki=4.9×10-10
Ki1=4.3×10-7
Ki2=5.6×10-11
下列选项错误的是
A.HCN+CO32- = CN-+ HCO3-
B.2HCOOH+CO32- = 2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
高二化学选择题中等难度题查看答案及解析