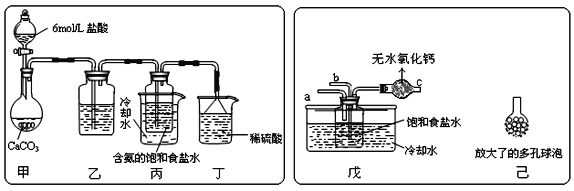
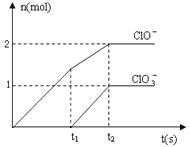
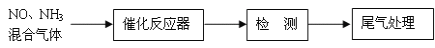
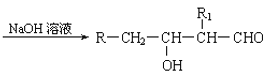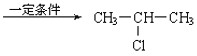-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A. 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
B. 氢氧燃料电池的负极反应式:O2 +2H2O+ 4e-=4OH-
C. 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D. 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
难度: 中等查看答案及解析
-
常温下,在溶液中可以发生反应:X+2Y3+=2Y2++X2+。对下列叙述的判断正确的是( )
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物 ⑤Y2+具有还原性 ⑥Y3+的氧化性比X2+的氧化性强
A.②④⑥ B.①③④ C.①③⑤⑥ D.②⑤
难度: 中等查看答案及解析
-
下列物质中,不含有硅酸盐的是
A.硅芯片 B.水玻璃 C.黏土 D.普通水泥
难度: 简单查看答案及解析
-
下列可用来区别SO2和CO2气体的是
①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾 ⑤氯化钡 ⑥品红溶液
A.①④⑤⑥ B.①②③⑥ C.②③④⑤ D.②③④⑥
难度: 中等查看答案及解析
-
下列说法正确的是
A.非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
B.只有非金属能形成含氧酸或含氧酸盐
C.除稀有气体外的非金属元素都能生成不同价态的含氧酸
D.非金属的最高价含氧酸都具有强氧化性
难度: 简单查看答案及解析
-
下列有关氯元素单质及化合物性质的说法正确的是( )
A.液氯是纯净物,而氯水是电解质,漂白粉是混合物
B.氯气可用作消毒剂和漂白剂,是因为氯分子具有强氧化性
C.随着化合价的升高,氯的含氧酸酸性和氧化性均逐渐增强
D.氯化铝受热易升华,加压下加热得到熔融氯化铝不导电,故氯化铝是共价化合物
难度: 简单查看答案及解析
-
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
被提纯的物质
除杂试剂
分离方法
A
溴化钠溶液(NaI)
氯水、CCl4
萃取、分液
B
氯化铵溶液(FeCl3)
氢氧化钠溶液
过滤
C
二氧化碳(CO)
氧化铜粉末
通过灼热的CuO粉末
D
苯(苯酚)
浓溴水
过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.用MnO2催化H2O2分解时,每生成11.2L的O2转移NA个电子
B.标准状况下,22.4L SO3中含有的硫原子数目为NA
C.标准状况下,2.24L氧元素的单质所含原子数一定为0.2NA
D.6.4gS6与S8的混合物中所含硫原子数一定为0.2NA
难度: 简单查看答案及解析
-
在一定条件下,下列物质不能与二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤硝酸 ⑥氢氧化钠 ⑦氢氧化钙
A.③⑤⑦ B.⑤⑦ C.③⑤ D.⑤
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
①金属钠不能与NaOH溶液反应;②液溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方法提纯;③溴化银具有感光性,碘化银不具感光性;④某溶液与淀粉碘化钾溶液反应出现蓝色,则证明该溶液是氯水或溴水;⑤氟气能与氯化钠水溶液反应生成HF和O2;⑥氯气跟水反应时,水既不是氧化剂也不是还原剂。
A.只有①③⑤ B.只有②④⑥
C.只有②⑤⑥ D.只有①③④
难度: 简单查看答案及解析
-
下列叙述正确的是
①标准状况下,1molSO2和1molSO3具有相同的体积;②SO2使溴水、高锰酸钾酸性溶液褪色是因为SO2有漂白性;③SO2有漂白性,湿润的氯气也有漂白性,若将SO2和Cl2以等物质的量混合后通入品红溶液中,一定褪色更快;④SO2溶于水,得到的溶液有氧化性,还有还原性;⑤SO2通入Ba(OH)2溶液中,有白色沉淀生成,加入稀硝酸最终沉淀将全部溶解⑥SO2通入BaCl2溶液中无沉淀生成。
A.①② B.③⑤ C.④⑥ D.①③⑥
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.过量的二氧化硫通入氢氧化钠溶液中:SO2+2OH-=SO42-+H2O
B.澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O
C.碳酸氢钙溶液和氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O
D.碳酸钙和盐酸反应:CO32-+2H+=CO2↑+H2O
难度: 简单查看答案及解析
-
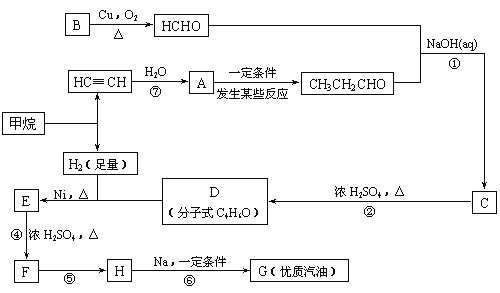
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
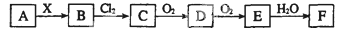
下列说法中不正确的是( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
难度: 中等查看答案及解析
-
把少量NO2体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.氧气 B.二氧化氮 C.二氧化氮和氧气 D.二氧化氮和一氧化氮
难度: 困难查看答案及解析
-
一定条件下,可逆反应C(s) + CO2(g)
2CO(g) △H>0,达到平衡状态,进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④ B.①③ C.①② D.①③④
难度: 简单查看答案及解析
-
向含0.2molNaOH和0.1molBa(OH)2的溶液中持续稳定地通入6.72L(已换算成标准状况)CO2气体。下列表示溶液中离子的物质的量与通入CO2的体积关系的图象中,符合题意的是(气体的溶解和离子的水解都忽略不计)( )
A.

B.

C.
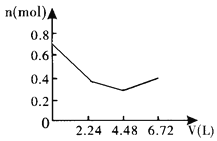
D.
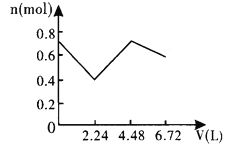
难度: 中等查看答案及解析