-
硅及其化合物是带来人类文明的重要物质。下列说法正确的是
A.陶瓷、水晶、水泥、玻璃都属于硅酸盐
B.水玻璃是纯净物,可用于生产黏合剂和防火剂
C.某硅酸盐的化学式为KAlSi3O8,可用K2O·Al2O3·6SiO2表示
D.高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池
难度: 中等查看答案及解析
-
下列实验操作正确的是
选项
实验
操作
A
观察钠与水反应的现象
用镊子从煤油中取出金属钠,切下黄豆大小的钠,小心放入装满水的烧杯中
B
检验NaHCO3与Na2CO3溶液
用小试管分别取少量溶液,然后滴加澄清石灰水
C
证明Na2O2与CO2是放热反应
Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应
D
检验Na2CO3与K2CO3溶液
用铂丝分别蘸取溶液,在酒精灯外焰上灼烧,直接观察火焰的颜色
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
离子方程式BaCO3 + 2H+ = CO2↑ + H2O + Ba2+ 中的H+不能代表的物质是( )
①HCl;②H2SO4;③HNO3;④NaHSO4;⑤CH3COOH
A.①③ B.①④⑤ C.②④⑤ D.⑤
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
B.Na2O2晶体中阳离子和阴离子个数比为2:1
C.Na2O2与CO2反应生成0.1 mol O2时转移电子0.4 mol
D.向饱和烧碱溶液中加入2 g Na2O2,充分反应完后,溶液中c(Na+)不变
难度: 简单查看答案及解析
-
某合金与铁的物理性质的比较如下表所示:
熔点/℃
密度/gcm -3
硬度(金刚石为10)
导电性(银为100)
某合金
2 500
3.00
7.4
2.3
铁
1 535
7.86
4.5
17
还知该合金耐腐蚀、强度大。从以上性能看,该合金不适合作( )
A.导线 B.门窗框 C.炉具 D.飞机外壳
难度: 简单查看答案及解析
-
某溶液含有K+、Fe3+、SO42-、OH-、I-中的几种。取样,滴加KSCN溶液后显血红色。为确定该溶液的组成,还需检验的离子是( )
A.K+ B.I- C.SO42- D.OH-
难度: 中等查看答案及解析
-
下列除去杂质(括号中的物质为杂质)的方法中,不正确的是( )
A.FeCl3溶液(FeCl2):通入适量Cl2
B.Fe2O3固体(Al2O3):加入烧碱溶液,过滤
C.CO2气体(HCl):通过Na2CO3溶液洗气后干燥
D.Na2CO3固体(NaHCO3):加热
难度: 中等查看答案及解析
-
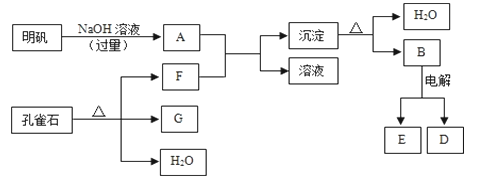
铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是( )

A. ①中还需要进行过滤操作,滤渣为二氧化硅
B. a、b中铝元素的存在形式不同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓
B. 铝粉投入到NaOH溶液中:2Al+2OH- = 2AlO2-+H2↑
C. 钠和冷水反应:2Na+2H2O=2Na++2OH-+H2↑
D. 向澄清石灰水中滴入足量碳酸氢钠溶液:Ca2++OH-+HCO3- =CaCO3↓+H2O
难度: 中等查看答案及解析
-
下列各组微粒在指定溶液中一定能大量共存的是( )
A.稀硫酸溶液:NH4+、Al3+、Cl-、K+
B.使酚酞变红的溶液:Na+、HSO3-、Cl-、Ba2+
C.FeCl2溶液:H+、NO3-、Ag+、K+
D.无色透明的溶液:H+、Na+、MnO4-、SO42-
难度: 中等查看答案及解析
-
下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是
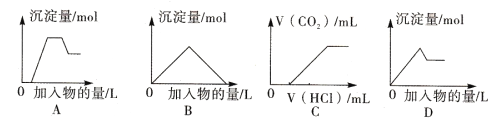
A. 图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B. 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C. 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D. 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
难度: 困难查看答案及解析
-
二氧化硅是一种化工原料,可以制备一系列物质。下列说法正确的是( )
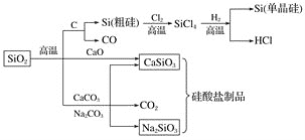
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
难度: 中等查看答案及解析
-
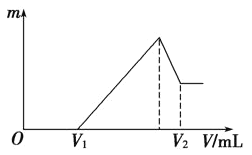
下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是

A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的A1C13溶液中滴入NaOH溶液至过量。
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
难度: 中等查看答案及解析
-
工业上制备二氧化氯(ClO2)的方法之一是用甲醇在酸性介质中与氯酸钠反应,其反应方程式为:CH3OH+NaClO3+H2SO4→C1O2↑+CO2↑+Na2SO4+H2O(未配平),则下列说法正确的是( )
A.甲醇是氧化剂
B.通过反应可判断NaClO3的氧化性强于Na2SO4
C.还原产物和氧化产物的物质的量之比为5:l
D.生成1molCO2时转移电子的物质的量为6mol
难度: 中等查看答案及解析
-
向100mLFeBr2溶液中通入标况下氯气6.72L,氯气全部被还原,测得溶液c(Br-)=c(Cl-),原溶液中FeBr2溶液的浓度( )(mol·L-1)
A.2 B.4 C.4.5 D.6
难度: 中等查看答案及解析
-
在反应SiO2+3C
SiC+2CO↑中,氧化剂与还原剂的质量比是
A. 36∶60 B. 60∶36 C. 1∶2 D. 1∶3
难度: 简单查看答案及解析
-
甲、乙两烧瓶中各盛有100mL 5mol·L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为( )
A.2.7g B.3.6g C.5.4g D.6.75g
难度: 中等查看答案及解析