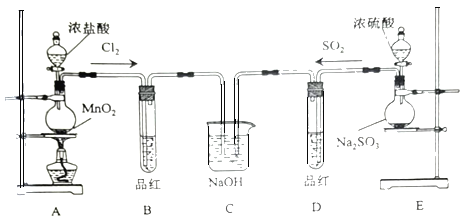
-
连云港拥有一百七十多公里的海岸线,“关注海洋健康,守护蔚蓝星球”义不容辞。下列有关说法正确的是( )
A.必须通过化学变化才能从海水中获得食盐
B.海水中的溴、碘可用四氯化碳直接萃取得到
C.海洋有很强的自净能力,各类污水可直接排入海水中
D.近海频发的“赤潮”与生活污水中含氮、磷元素过多有关
难度: 简单查看答案及解析
-
硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是( )
A.陶瓷 B.金刚石 C.水晶 D.大理石
难度: 简单查看答案及解析
-
下列过程属于化学变化的是( )
A.碘的升华 B.钢铁生锈 C.滴水成冰 D.液氨气化
难度: 简单查看答案及解析
-
日常生活中离不开各类化学物质。下列物质属于盐类的是( )
A.酒精 B.食醋 C.纯碱 D.蔗糖
难度: 简单查看答案及解析
-
下列实验方法不能达到实验目的的是( )
A.用盐酸除去镁粉中的少量铝粉
B.用加热法除去NaCl固体中少量的NH4Cl
C.用饱和 NaHCO3溶液除去CO2中的HCl气体
D.利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
难度: 中等查看答案及解析
-
下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
A.Fe与Cl2反应
B.CO2通入石灰水
C.HNO3中加入Cu
D.AlCl3溶液中滴入NaOH溶液
难度: 中等查看答案及解析
-
下列有关工业生产的叙述中错误的是( )
A.用CO还原赤铁矿炼铁
B.电解NaCl溶液制金属Na
C.用N2和H2合成NH3
D.高温下用C还原SiO2制Si
难度: 中等查看答案及解析
-
下列有关物质用途的说法正确的是( )
A.SiO2是良好的半导体材料
B.NaOH可用于治疗胃酸过多
C.Na2O2可用作潜水艇的供氧剂
D.明矾可用作自来水的消毒剂
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.硅的原子结构示意图:

B.中子数为10的氧原子:
O
C.漂白粉有效成分的化学式;CaClO
D.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32﹣
难度: 中等查看答案及解析
-
下列关于Na2CO3和 NaHCO3的说法中错误的是( )
A.NaHCO3俗称小苏打
B.Na2CO3和 NaHCO3溶液可用Ca(OH)2溶液鉴别
C.用加热法除去Na2CO3固体中少量的 NaHCO3
D.等物质的量的Na2CO3和NaHCO3分别与足量的盐酸反应,生成相同质量的CO2
难度: 中等查看答案及解析
-
下列各组离子在指定条件下能大量共存的是( )
A.无色溶液中:Na+、Cu2+、Cl﹣、NO3﹣
B.澄清透明溶液中:Mg2+、Na+、SO42﹣、Cl﹣
C.强酸性溶液中:Na+、AlO2﹣、OH﹣、SO32﹣
D.强碱性溶液中:Fe3+、Ca2+、NO3﹣、SCN﹣
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.腐蚀铜制印刷电路板:Cu+Fe3+=Cu2++Fe
B.硫酸铝溶液中加入过量氨水:Al3++3OH﹣=Al(OH)3↓
C.氯气通入水中:Cl2+2H2O⇌2H++Cl﹣+ClO﹣
D.钠与水反应:2Na+2H2O=2Na++2OH﹣+H2↑
难度: 中等查看答案及解析
-
下列装置中能达到实验目的的是( )
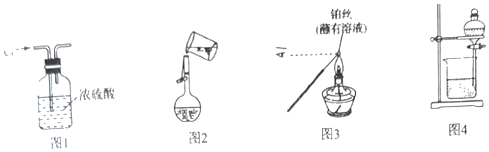
A.可用图1干燥氯气
B.可用图2向容量瓶中转移溶液
C.可用图3检验样品中钾元素
D.可用图4分离乙醇和水
难度: 简单查看答案及解析
-
下列物质在一定条件下能一步实现转化的是( )
A.Cu→CuO→Cu(OH)2 B.N2→NO2→HNO3
C.Na→NaOH→Na2CO3 D.S→SO3→H2SO4
难度: 中等查看答案及解析
-
氯气是一种有毒的气体,可用钢瓶储存,一旦氯气发生泄漏,必须采取果断措施,下列有关做法错误的是( )
A.人群向高处疏散
B.向泄漏地点撒一些石灰
C.用浸有弱碱性溶液的毛巾捂住口鼻
D.向泄漏地点喷酒食盐水
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.H216O和H218O属于同位素
B.相同体积的CO2、NO2具有相同的分子数
C.NaCl溶液能导电,所以NaCl溶液是电解质
D.配制溶液时,容量瓶中原来有少量蒸馏水不会影响实验结果
难度: 中等查看答案及解析
-
如图是某硫酸试剂标签上的部分内容。下列说法错误的是( )

A.常温下,该硫酸可以用铁制容器运输
B.敞口放置的该硫酸因挥发而导致浓度变小
C.该硫酸的物质的量浓度为18.4mol•L﹣1
D.配制250mL0.4mol•L﹣1的稀硫酸需取该硫酸约5.4mL
难度: 中等查看答案及解析