-
下列关于ⅦA族元素的叙述正确的是
A.ⅦA族元素是同周期中原子半径最大的元素(惰性气体元素除外)
B.ⅦA族元素是同周期中非金属性最弱的元素
C.ⅦA族元素的最高正价都是+7价
D.ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数
难度: 中等查看答案及解析
-
短周期元素A、B、C、D的原子序数依次增大。A原子的最外层电子数是内层电子数的2倍,元素B在同周期的主族元素中原子半径最大,元素C的合金是日常生活中常用的金属材料,D位于第VIA族。下列说法正确的是
A.原子半径:D>B>C>A
B.元素A、B的氧化物具有相同类型的化学键
C.B、C、D的最高价氧化物对应的水化物能相互反应
D.元素B和C的最高价氧化物对应水化物的碱性:C>B
难度: 中等查看答案及解析
-
下列有关微粒性质的排列顺序中,错误的是
A.元素的电负性:P<O<F
B.元素的第一电离能:C<N<O
C.离子半径:O2->Na+>Mg2+
D.原子的未成对电子数:Mn>Si>Cl
难度: 简单查看答案及解析
-
关于原子序数从11到17的七种元素,下列说法不正确的是
A. 原子半径逐渐减小
B. 原子的最外层电子数逐渐增多
C. 元素的金属性逐渐减弱,非金属性逐渐增强
D. 若其中某非金属元素最高价氧化物对应水化物的化学式为HnROm,则其气态氢化物的化学式为H2m−nR
难度: 中等查看答案及解析
-
钾长石的主要成分为硅酸盐,由前20号元素中的四种组成,化学式为
其中,只有W显负价.X、Y的最外层电子数之和与Z的最高正价数相等.
与W的阴离子具有相同的电子层结构.X、W的质子数之和等于Y、Z的质子数之和.下列说法错误的是
A.W的离子半径
的离子半径
B.Z的氢化物稳定性
的氢化物稳定性
C.Y的氧化物既能与盐酸,又能与NaOH溶液反应
D.
、
两种化合物含有的化学键类型完全相同
难度: 中等查看答案及解析
-
X、Y、Z、W为短周期主族元素,原子序数依次增大,X原子的最外层电子数是第一层电子数的2倍,Y的气态氢化物与最高价氧化物的水化物可形成盐,Z的最外层电子数与其电子总数比为3:8,下列说法正确的是
A.X、Y、W的最高价含氧酸酸性顺序:
B.Z、W可形成
的化合物,属于离子化合物
C.离子半径:
D.气态氢化物的稳定性:
难度: 中等查看答案及解析
-
下列气态氢化物按稳定性由强到弱顺序的是
A.HBr、HCl、HF B.HF、
、
C.
、
、
D.
、
、
难度: 中等查看答案及解析
-
短周期主族元素a、b、c、d的原子序数依次増大,已知a、c同主族且c的原子序数是a的2倍,b元素的单质既能溶于稀硫酸、又能溶于氢氧化钠溶液。下列有关説法正确的是
A.a的简单氢化物的沸点比c的高,且原子半径:a>c
B.b的简单离子与c的简单离子具有相同的电子层结构
C.工业上通过电解b2a3或bd3均可得到b单质
D.a与c形成的化合物的水溶液可使紫色石蕊试液变紅
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、M、R 的原子半径和最外层电子数之间的关系如图所示。下列说法正确的是
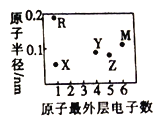
A. 化合物X2M 是弱电解质 B. 化合物RX 中含共价键
C. M的单质在常温下为气体 D. Y、Z 的氧化物均能溶于水
难度: 中等查看答案及解析
-
RbH是一种离子化合物,它跟水反应的方程式为:
,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气,下列有关RbH的叙述错误的是
A.灼烧RbH时,火焰有特殊颜色
B.RbH中
半径比
半径小
C.跟液氨反应时,有
生成
D.在Na、K、Rb三种单质中,Rb的熔点最低
难度: 中等查看答案及解析
-
四种短周期元素在元素周期表中的相对位置如图所示,其中丙元素最外层电子数是其电子层数的2倍。下列叙述正确的是
甲
乙
丙
丁
A.四种元素中原子半径最大的是丁
B.氧化物对应水化物的酸性:丁一定强于丙
C.单核阴离子还原性:乙强于丙
D.甲的气态氢化物可与其最高价氧酸反应生成离子化合物
难度: 中等查看答案及解析
-
W、X、Z、Y 为核电荷数依次增大的前 20 号主族元素,W 的原子中只有 1 个电子,X与 Y 同族,Y 的一种单质在空气中易自燃,W 与 Z 形成的二元化合物和水反应可生成W 的单质。 下列说法正确的是
A.W 分别与 Y、Z 形成的化合物中化学键类型相同
B.Y 的氧化物的水化物是强酸
C.氢化物沸点:
D.简单离子半径:
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法错误的是()
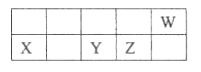
A.原子半径由大到小的顺序:X、Y、Z、W
B.元素最高正价由低到高的顺序:X、Y、Z、W
C.简单氢化物的热稳定性由弱到强的顺序:Y、Z、W
D.最高价氧化物的水化物的酸性由弱到强的顺序:X、Y、Z
难度: 简单查看答案及解析
-
下列元素中,原子半径最大的是
A.Na B.Al C.P D.S
难度: 简单查看答案及解析
-
V、W、X、Y均是元素周期表中短周期元素,在周期表中的相对位置关系如表所示:
Y
V
X
W
Z为第四周期常见元素,该元素是人体血液中血红蛋白最重要的组成金属元素。V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成。下列说法正确的是
A.原子半径:X>Y>V>W
B.X、W的质子数之和与最外层电子数之和的比值为2∶1
C.甲、乙混合时所生成的白烟为离子化合物,但其中含有共价键
D.少量Z的单质与过量W的单质可化合生成ZW2
难度: 中等查看答案及解析
-
六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E,B与F同主族,E与F同周期;D的核电荷数是F的最外层电子数的2倍;B的最高正价与最低负价的代数和为0;常温下单质A与E的状态不同。下列判断正确的是
A.A、C两种元素只能组成化学式为CA3的化合物
B.F与D形成的化合物性质很不活泼,不与任何酸反应
C.原子半径由大到小的顺序是E>F>C>D
D.元素的非金属性由强到弱的顺序是D>C>F>B
难度: 中等查看答案及解析
-
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.下列说法正确的是
A.五种元素中原子半径最大的是E,最小的是A
B.A和B、D、E均能形成共价型化合物中,稳定性最差的是A、D形成的化合物
C.E最高价氧化物对应水化物化学式为
D.C的单质在空气中燃烧产物的化学式为
难度: 中等查看答案及解析
-
已知X、Y是两种短周期主族元素,下列有关说法中一定正确的是( )
选项
条件
结论
A
若原子半径:X>Y
原子序数:X>Y
B
若最高价氧化物对应水化物的酸性:X>Y
元素的非金属性:X>Y
C
若价电子数:X>Y
最高正化合价:X>Y
D
若X、Y最外层电子数分别为1、7
X、Y 之间一定能形成离子键
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列结论错误的是( )
①微粒半径:r(K+)>r(Al3+)>r(S2-)>r(Cl-) ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A.① B.①③ C.②③④⑤⑥⑦ D.①③⑤
难度: 中等查看答案及解析
-
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
A.Y元素最高价氧化物对应的水化物化学式H2YO4
B.原子半径由大到小的顺序为:Z>Y> W
C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定
D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2
难度: 中等查看答案及解析
 沉淀
沉淀