-
下列物质中,不能使溴的四氯化碳溶液和高锰酸钾酸性溶液褪色的是( )
A. C2H4 B. C3H6 C. C5H12 D. C4H8
难度: 中等查看答案及解析
-
我国中医药文化源远流长,诺贝尔化学奖得主屠呦呦曾在某次演讲中提及:“当年我面临研究困境时,又重新温习中医古籍,进一步思考东晋葛洪《肘后备急方》中有关‘青蒿一握,以水二升渍,绞取汁,尽服之’的截疟记载。这使我联想到提取过程可能需要避免高温,由此改用低沸点溶剂的提取方法。”目前从青蒿中提取青蒿素的方法主要有乙醚浸提法和汽油浸提法,此处用到的有机物提纯方法是( )
A.过滤 B.蒸馏 C.萃取 D.重结晶
难度: 简单查看答案及解析
-
下列叙述中,正确的是( )
①电池是将电能转变成化学能的装置
②电解池是将化学能转变成电能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,是物理变化
A.①②③④ B.③④ C.③④⑤ D.④
难度: 简单查看答案及解析
-
下列物质的分离或鉴别方法正确的是( )
A.用分液法分离碘酒和CCl4 B.仅用硝酸银溶液可验证卤代烃中卤原子的种类
C.用银氨溶液鉴别甲酸乙酯积苯甲醛 D.仅用氯化铁溶液可区分苯酚稀溶液和甘油
难度: 简单查看答案及解析
-
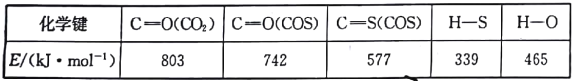
化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)均变大
B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C.向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3)
D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
难度: 中等查看答案及解析
-
假蜜环菌甲素可作为药物用于治疗急性胆道感染,病毒性肝炎等疾病,其结构简式如图所示。假蜜环菌甲素不能发生的化学反应是( )
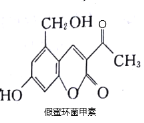
A.消去反应
B.加成反应
C.水解反应
D.酯化反应
难度: 中等查看答案及解析
-
如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是 ( )
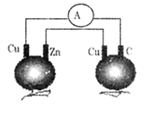
A. 石墨是阴极
B. 两个铜片上都发生氧化反应
C. 锌片是负极
D. 两个番茄都形成原电池
难度: 中等查看答案及解析
-
下列各组物质在题设条件下能够发生反应,且甲为取代反应,乙为加成反应的是
选项
甲
乙
A
甲烷与氯水(光照)
乙烯与溴的四氯化碳溶液
B
苯与液溴(催化剂)
苯与氢气(加热、催化剂)
C
乙醇与乙酸的酯化反应(加热、催化剂)
乙酸乙酯的水解反应(催化剂)
D
乙醇和氧气(灼热的铜丝)
氯乙烯与氢气(催化剂)
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
已知25℃、10lkPa条件下:4Al(s)+3O2(g)=2Al2O3(s) △H=-2834.9kJ/mol;4Al(s)+2O3(g)=2Al2O3(s) △H=-3119.1kJ/mol,由此得出的正确结论是
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量低,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
难度: 简单查看答案及解析
-
一定温度下,对可逆反应A(g)+2B(g)
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
难度: 中等查看答案及解析
-
对于常温下pH=2的醋酸溶液,下列叙述正确的是
A. c(H+)=c(CH3COO-)
B. 加水稀释时
增大
C. 与pH = 12的NaOH溶液等体积混合后,溶液呈中性
D. 加入醋酸钠固体可抑制醋酸的电离,电离常数Ka变小
难度: 困难查看答案及解析
-
现有两个热化学方程式
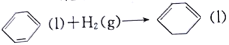 △H>0 ①
△H>0 ①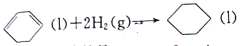 △H<0 ②
△H<0 ②下列说法正确的是( )
A.反应①②中都存在△S>0 B.高温时,反应②可自发进行
C.在通常情况下,①②都能自发进行 D.反应①一定不能自发进行
难度: 简单查看答案及解析
-
某有机物分子中含有n个—CH2—,m个—CH—,a个—CH3,其余为—OH,则分子中—OH的个数为( )
A. 2n+3m-a B. m+2-a C. n+m+a D. m+2n+2-a
难度: 中等查看答案及解析
-
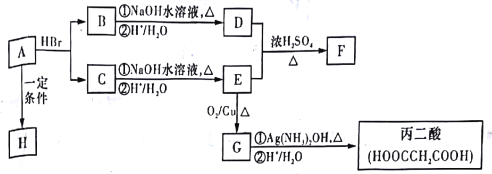
傅克反应是合成芳香族化合物的一种重要方法。有机物a和苯通过傅克反应合成b的过程表示如下(无机小分子产物略去):
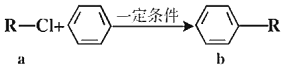
下列说法不正确的是( )
A.该反应是取代反应
B.若R为-CH3,则a的电子式为
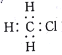
C.若R为C4H9时,b的结构可能有4种(不考虑立体异构)
D.若R为C4H5O时,1molb最多可与5molH2加成
难度: 中等查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A.①压强对反应的影响(p2>p1) B.②温度对反应的影响
C.③平衡体系增加N2对反应的影响 D.④催化剂对反应的影响
难度: 中等查看答案及解析
-
在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)⇌H2(g)+CO2(g)。在500℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
A.25% B.50% C.75% D.80%
难度: 简单查看答案及解析
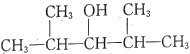 B.
B.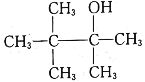
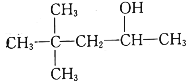 D.CH3(CH2)5CH2OH
D.CH3(CH2)5CH2OH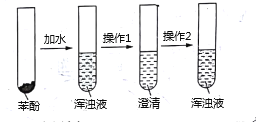
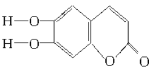 具有抗菌作用。若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗Br2___mol,消耗NaOH___mol。
具有抗菌作用。若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗Br2___mol,消耗NaOH___mol。