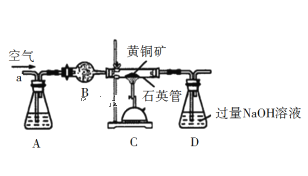
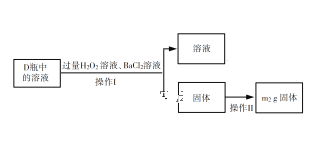
-
下列物质的应用中,利用了该物质氧化性的是
A. 氨——作制冷剂 B. 漂粉精——作游泳池消毒剂
C. 甘油——作护肤保湿剂 D. 明矾——我国古时用于除铜锈
难度: 中等查看答案及解析
-
将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500 mL NaOH溶液完全吸收,生成NaNO2和NaNO3两种盐溶液,其中NaNO3的物质的量为0.2mol,则NaOH的浓度为
A.2mol/L B.1.8mol/L C.2.4 mol/L D.3.6 mol/L
难度: 困难查看答案及解析
-
化学与生产、生活、环境等息息相关,下列说法不正确的是 ( )
A.滑石粉[Mg3(Si4O10)(OH)2]属于无机硅酸盐类物质,滑石粉的组成可表示为3MgO·4SiO2·H2O
B.次氯酸钠、石灰、明矾可作消毒杀菌剂;硫酸钡俗称“钡餐”,是一种医疗药品
C.水结冰时体积膨胀,密度减小,是因为水分子大范围以氢键相连,形成疏松晶体
D.天然纤维包括棉花、羊毛、蚕丝和麻等,毛、发的主要成分都是蛋白质,其水解的最终产物是氨基酸
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是( )
A.10gH218O中所含的中子数为5NA
B.标准状况2.24L苯在O2中完全燃烧,得到0.6NA个CO2分子
C.常温下,pH=1的NH4NO3溶液,NO3-的数目为0.1NA
D.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.向水中通入氯气:Cl2+H2O===2H+ + ClO−+ Cl−
B.向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3−+2OH−===CaCO3↓+CO32−+2H2O
C.向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2−+4NH4++2H2O
D.将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
难度: 中等查看答案及解析
-
下列关于物质分类的说法正确的是( )
①SO2和NO2都能和碱液反应,属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤NaHCO3是发酵粉的主要成分之一,Na2CO3可治疗胃酸过多
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物
A.①③⑤ B.④⑤⑥ C.②③④ D.②④⑥
难度: 中等查看答案及解析
-
有关有机物的性质说法正确的是( )
A.将石油、煤分别隔绝空气加强热后所得的气体通过溴水,溴水均可褪色。
B.聚酯纤维(涤纶)、合成橡胶、有机玻璃都是通过同一反应类型制得的
C.在乙苯的碳碳单键中插入—C3H6—,共有9种同分异构体
D.海带提取碘、皂化反应中C2H5OH的作用相同
难度: 中等查看答案及解析
-
下列实验结果不能作为相应定律或原理的证据之一的是(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
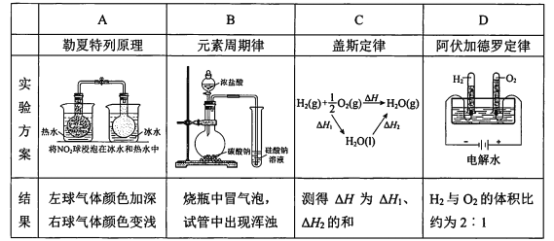
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
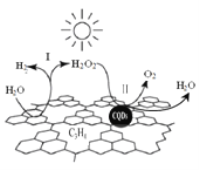
A. C3N4中C的化合价为−4
B. 反应的两个阶段均为吸热过程
C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D. 通过该反应,实现了化学能向太阳能的转化
难度: 中等查看答案及解析
-
科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是
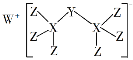
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
实验结论
A
向某溶液中加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失。
原溶液中一定有 SO42-
B
加入盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊。
原溶液中一定有CO32-
C
向某溶液中加入氢氧化钠溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝。
原溶液中一定无 NH4+
D
向某黄色溶液中加入淀粉 KI 溶液,溶液呈蓝色。
溶液中可能含 Br2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是( )
①盐卤(含MgCl2)
Mg(OH)2
MgCl2溶液
无水MgCl2
②铝土矿
AlO2-
Al(OH)3
Al2O3
③NH3
 NO
NONO2
HNO3
④NaCl溶液
Cl2
无水FeCl2
⑤S
SO3
H2SO4
⑥SiO2
Na2SiO3溶液
H2SiO3
A. ③⑥ B. ③⑤⑥ C. ①④⑤ D. ①③⑥
难度: 中等查看答案及解析
-
下列离子方程式中,不能正确表达反应颜色变化的是( )
A.向氯水中通入SO2气体,溶液浅黄绿色消失:Cl2 + SO2 + 2 H2O = 4H+ + 2Cl- + SO42-
B.向AgNO3溶液中加入一定量HCl溶液,后加入Na2S溶液,白色沉淀变黑色:2AgCl + S2- = Ag2S + 2Cl-
C.向氢氧化铁胶体中加入HI酸溶液,首先出现红褐色沉淀,后沉淀消失,溶液变为黄色:2Fe(OH)3 + 6H+ + 2I- = 2Fe2+ + I2 + 6H2O
D.向CrO42-中加入H2SO4溶液,颜色由黄色变为橙色:2CrO42-+2H+
Cr2O72-+H2O
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是( )
选项
操作
目的
A
用酚酞作指示剂,用标准的c mol·L-1盐酸滴定一定体积未知浓度的
溶液
测定
溶液的浓度
B
将一定量
固体溶于硝酸,加蒸馏水稀释至指定体积
配制一定物质的量浓度的
溶液
C
给含碎瓷片的石蜡油加强热,并将气体通入酸性高锰酸钾溶液中
证明气体产物含碳碳双键
D
在
溶液中滴加适量稀硫酸,再加入
草酸溶液。将溶液分成两份,其中一份中加入2mL
溶液,另一份中加入2mL蒸馏水
证明
能降低该反应的活化能
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下图是新型镁-锂双离子二次电池,下列关于该电池的说法不正确的是( )
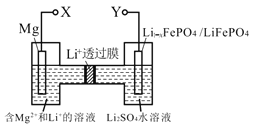
A. 放电时, Li+由左向右移动
B. 放电时, 正极的电极反应式为Li1-xFePO4+xLi++xe-=LiFePO4
C. 充电时, 外加电源的正极与Y相连
D. 充电时, 导线上每通过1mole-, 左室溶液质量减轻12g
难度: 中等查看答案及解析
-
已知:[FeCl4(H2O)2]-为黄色,下列实验所得结论不正确的是( )
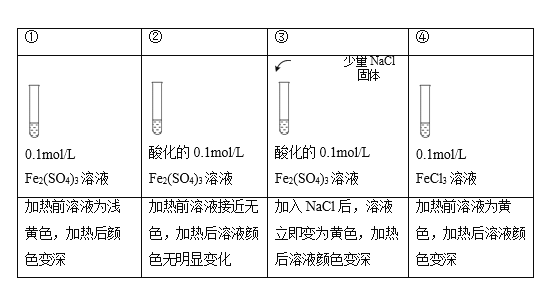
注:加热为微热,忽略体积变化。
A.实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3
B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C.实验③中,存在可逆反应: Fe3+ + 4Cl-+ 2H2O
[FeCl4(H2O)2]-
D.实验④,可证明升高温度,Fe3+水解平衡正向移动
难度: 中等查看答案及解析
-
甲、乙、丙三种不同的物质中均含有同一种元素,它们之间的转化关系如图示(部分反应物及生成物已略去)。下列说法错误的是:
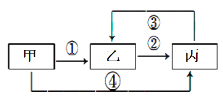
A.若甲为气态氢化物,乙为淡黄色固体,则丙具有漂白性
B.若甲为气体单质,乙为含有极性共价键的非极性分子,则反应②为吸热反应
C.若甲为金属氧化物,乙的水溶液呈酸性,则丙既能与强酸又能与强碱反应
D.若甲为金属单质,反应④为置换反应,则往乙溶液中滴加KSCN,溶液变为血红色
难度: 困难查看答案及解析
-
1,3-二异丙烯基苯
是重要的化工原料,下列说法正确的是( )
A.不可发生加聚反应 B.不能使稀的高锰酸钾溶液褪色
C.分子中所有原子共平面 D.其苯环上二氯代物有4种
难度: 简单查看答案及解析
-
三氯氢硅(SiHCl3)是光伏产业的一种关键化学原料,制备反应的方程式为Si(s)+3HCl(g)
SiHCl3(g)+H2(g),同时还有其他副反应发生。当反应体系的压强为0.05 MPa时,分别改变进料比[n(HCl)∶n(Si)]和反应温度,二者对SiHCl3产率影响如图所示。下列说法正确的是

A. 降低压强有利于提高SiHCl3的产率
B. 制备SiHCl3的反应为放热反应
C. 温度为450 K,平衡常数:K(x)>K (y)>K (z)
D. 增加HCl的用量,SiHCl3的产率一定会增加
难度: 中等查看答案及解析
-
25℃,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示,下列说法错误的是( )

A.H3AsO3为三元弱酸,其一级电离平衡常数Ka1=10-9
B.NaH2AsO3在溶液中水解程度大于电离程度
C.pH=9的溶液中c(H+)>c(H3AsO3)= c(H2AsO3-)
D.a点时,溶液中c(H2AsO3-)>c(H3AsO3)+ c(HAsO32-)
难度: 中等查看答案及解析