-
“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)===2NO(g) ΔH1= +180.5 kJ/mol
C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
2C(s)+O2(g)===2CO(g) ΔH3=-221 kJ/mol
若某反应的平衡常数表达式为K=[c(N2)·c2(CO2)]/[c2(NO)·c2(CO)],则此反应的热化学方程式为:_____________。
(2)N2O5在一定条件下可发生分【解析】
2N2O5(g) 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=________。2~5 min内用NO2表示的该反应的平均反应速率为________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________(用k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________(用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
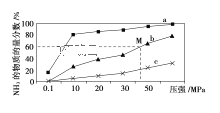
①曲线a对应的温度是________。
②M点对应的H2的转化率是________。
(5)常温下,联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的电离平衡常数值_______________。(已知:N2H4+H+ N2H5+的K=8.7×107 Kw=1.0×10-14)
N2H5+的K=8.7×107 Kw=1.0×10-14)
-
“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H1= +180.5 kJ/mol
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H3=-221 kJ/mol
若某反应的平衡常数表达式为:K= [c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为____________________________________。
(2)N2O5在一定条件下可发生分【解析】
2N2O5(g) 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
| t/ min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/<mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=__________。2~5 min内用NO2表示的该反应的平均反应速率为__________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__________。(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用 k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用 k正、k逆表示)。
(4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200℃、400℃、600℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
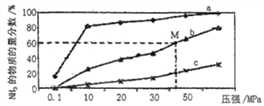
①曲线a对应的温度是__________。
②M点对应的H2的转化率是__________。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:______________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8。)
-
“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H1= +180.5 kJ/mol
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H3=-221 kJ/mol
若某反应的平衡常数表达式为:K= [c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为____________________________________。
(2)N2O5在一定条件下可发生分【解析】
2N2O5(g) 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
| t/ min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/<mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=__________。2~5 min内用NO2表示的该反应的平均反应速率为__________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__________。(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用 k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用 k正、k逆表示)。
(4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200℃、400℃、600℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
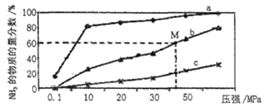
①曲线a对应的温度是__________。
②M点对应的H2的转化率是__________。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:______________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8。)
-
“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(I)汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:



若某反应的平衡常数表达式为 ,则此反应的热化学方程式为_______。
,则此反应的热化学方程式为_______。
(2) 在一定条件下可发生分【解析】
在一定条件下可发生分【解析】
 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
a.  和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c.  d. 气体的密度保持不变
d. 气体的密度保持不变
(Ⅱ)甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。 CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(3)将 和
和 按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成
按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
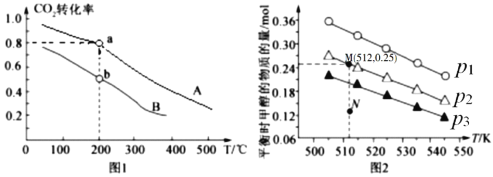
①a、b两点化学反应速率分别用 ,表示,则
,表示,则 _____
_____ (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
②列出a点对应的平衡常数表达式K= ____________________。
(4)在1.0 L恒容密闭容器中投入1 mol  和2.75 mol
和2.75 mol  发生反应:CO2(g) + 3H2(g)
发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为
D.在 及512 K时,图中N点
及512 K时,图中N点
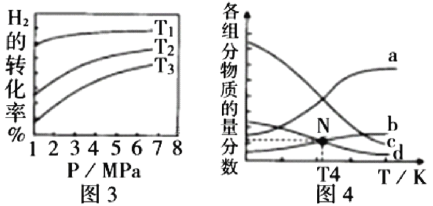
(5) 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)  C2H5OH(g) + 3H2O(g)
C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即 。
。
① 图3中投料比相同,温度 ,则该反应的焓变
,则该反应的焓变 _______0(填
_______0(填 )。
)。
② m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式)。
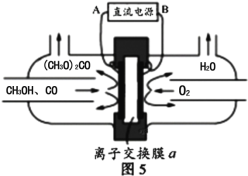
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。离子交换膜a为 ______(填“阳膜”、“阴膜”),阳极的电极反应式为_______________________________________
-
“绿水青山就是金山银山”,近年来我国着力推进绿色发展、循环发展等,形成节约资源和环境保护的空间格局。
Ⅰ.为了寻求对环境无污染燃料燃烧法,有人曾研究了在标准条件下氮的氧化物与碳的氧化物相互作用的机理。
(1)确定该反应的反应过程如下:
第一步:NO2(g)+CO(g)→O—N…O…C…O—O △H=+134kJ/mol
第二步:O—N…O…C—O→NO(g)+CO2(g) △H=-368kJ/mol
总反应式:NO2(g)+CO(g)→NO(g)+CO2(g) △H=___kJ/mol
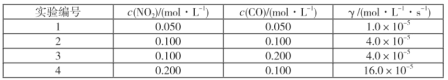
(2)对于任意一个化学反应,通过实验可以确定其反应速率与反应物浓度的定量关系:γ=kcm(NO2)·cn(CO),该方程称为速率方程,其中k称为速率常数。分析表中数据,写出该反应的速率方程表达式:___。
II.活性炭也可处理大气污染物NO,其原理:2NO(g)+C(s) CO2(g)+N2(g) △H>0。在T℃时,在容积一定的刚性容器中加入NO气体和活性炭粉,使之发生反应测得各物质的物质的量如下:
CO2(g)+N2(g) △H>0。在T℃时,在容积一定的刚性容器中加入NO气体和活性炭粉,使之发生反应测得各物质的物质的量如下:
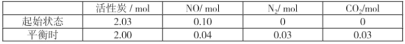
(3)计算T℃时,该反应的平衡常数K=___。
(4)为了提高NO的转化率和反应速率,可采取的措施有___(填字母)。
A.增加NO的用量 B.增加活性炭的用量
C.升高温度 D.增大体系压强
Ⅲ.用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示。
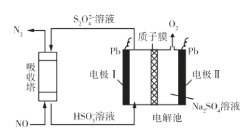
(5)电极I电极反应式为___。
(6)电解时H+的移动方向___(填“从左向右”、“从右向左”或“不移动”)
(7)标况下,每处理1molNO的同时,可产生O2的体积___L。
-
2017世界环境日中国主题:“绿水青山就是金山银山。”倡导保护自然,践行绿色生活,共同建设美丽中国。下列做法应提倡的是
A. 积极开发太阳能等新能源汽车 B. 推广使用一次性塑料袋和纸巾
C. 工业污水直接用于农田的灌溉 D. 大量生产防霾口罩以治理PM2.5
-
十八大以来,习近平总书记在多个场合强调,“绿水青山就是金山银山”,对环境生态环保尤为重视,下列说法不符合绿色化学理念的是
A. 开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
B. 利用有机垃圾发酵生产沼气做生活燃料
C. 将造纸废水通过高压水井压到地下,节约成本
D. 积极开发废旧电池的综合利用技术,解决电池中的重金属对土壤和水体的污染
-
“绿水青山就是金山银山”,研究NO2、NO、CO、NO2-、碳氢化合物大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:汽车尾气中的CO、NOx、碳氮化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知: N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol K1(该反应的平衡常数)
2C(s) +O2(g) =2CO(g) △H2=-221kJ/mol K2 (同上)
C(s) +O2(g) =CO2(g) △H3=-393.5kJ/mol K3(同上)
写出NO(g) 与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式_________,以及该热化学方程式的平衡常数K=________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO 4CO2+N2 △H=-1200kJ/mol。
4CO2+N2 △H=-1200kJ/mol。
①某温度下,在2L密闭容器中充入0.lmolNO2和02m1CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时NO2的平均反应速率v(NO2)=_________mol/(L·s)。
②若容器中观察到____________________________,可判断该反应达到平衡状态;
③能使该反应的反应速率增大,且平衡向逆反应方向移动的是_______。
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
(3)电化学降解NO2-的原理如图:
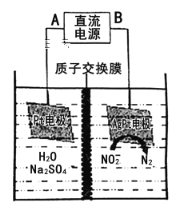
阴极反应式为_____________________________________。
(4)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
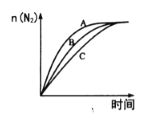
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图。活化能最小的是________[用E(A)、E(B)、E(C)表示三种催化剂下该反应的活化能]。
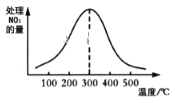
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图。试说明图中曲线先增大后减小的原因____________________________________________________(假设该温度范围内催化剂的催化效率相同)。
-
“绿水青山就是金山银山”,研究NO2、NO、CO、NO2-、碳氢化合物大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知: 汽车尾气中的CO、NOx、碳氮化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知: N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol K1(该反应的平衡常数)
2C(s) +O2(g) =2CO(g) △H2=-221kJ/mol K2 (同上)
C(s) +O2(g) =CO2(g) △H3=-393.5kJ/mol K3(同上)
写出NO(g) 与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式_________,以及该热化学方程式的平衡常数K=________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO 4CO2+N2 △H=-1200kJ/mol。
4CO2+N2 △H=-1200kJ/mol。
①某温度下,在2L 密闭容器中充入0.lmol NO和02m1CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时NO2的平均反应速率v(NO2)=_________mol/(L·s)。
②若此温度下,某时刻测得NO2、CO、CO2、 N2的浓度分别为1mol/L、0.4mol/L、0.lmol/L、a mol/L,要使反应向逆反应方向进行,a 的取值范围_________。
③能使该反应的反应速率增大,且平衡向逆反应方向移动的是_______。
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
(3)电化学降解NO2-的原理如下图:
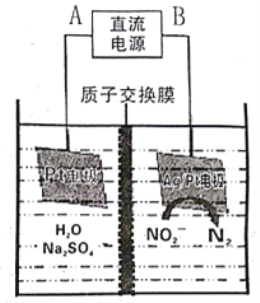
①电源的正极是___ (填A或B),阴极反应式为___________。
②若电解过程中转移了3mol 电子,则膜两侧电解液的质量变化差 为______g。
为______g。
-
“绿水青山就是金山银山”,因此如何消除大气污染物中的NOx、SO2等气体成为人们关注的主要问题之一。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)= NH4HSO3(aq) ΔH1= a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2= b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3= c kJ/mol。
则反应2SO2(g)+ 4NH3·H2O(aq)+ O2(g) = 2(NH4)2SO4(aq)+ 2H2O(l)的ΔH=______kJ/mol。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g) ΔH =−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH =−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 时间/min 浓度/mol·L−1 | 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~20 min内,平均反应速率v(SO2)=_____mol/(L·min)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是_____(填字母)。
A.通入一定量的O2 B.加入一定量的粉状碳酸钙
C.适当缩小容器的体积 D.加入高效的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。
N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。
①已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
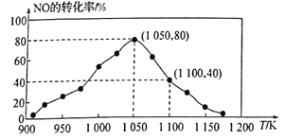
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为________________________________;
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×105Pa时,该反应的化学平衡常数Kp=_____________________ [已知:气体分压(P分)=气体总压(P)×体积分数]。
(4)氮氧化物也可以用尿素[(NH2)2CO]水溶液吸收。用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为___________________________________。
(5)汽车尾气吸收还可利用反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正= k正·c2(NO)·c2(CO),v逆= k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正= k正·c2(NO)·c2(CO),v逆= k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的恒容密闭容器中充入1 molCO和1 mol NO,在一定温度下达到平衡时,CO的转化率为80%,则k正︰k逆=_____L/mol。
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________(用k正、k逆表示)。

N2H5+的K=8.7×107 Kw=1.0×10-14)












