-
“绿水青山就是金山银山”,因此如何消除大气污染物中的NOx、SO2等气体成为人们关注的主要问题之一。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)= NH4HSO3(aq) ΔH1= a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2= b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3= c kJ/mol。
则反应2SO2(g)+ 4NH3·H2O(aq)+ O2(g) = 2(NH4)2SO4(aq)+ 2H2O(l)的ΔH=______kJ/mol。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g) ΔH =−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH =−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 时间/min 浓度/mol·L−1 | 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~20 min内,平均反应速率v(SO2)=_____mol/(L·min)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是_____(填字母)。
A.通入一定量的O2 B.加入一定量的粉状碳酸钙
C.适当缩小容器的体积 D.加入高效的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。
N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。
①已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
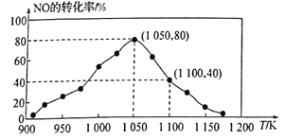
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为________________________________;
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×105Pa时,该反应的化学平衡常数Kp=_____________________ [已知:气体分压(P分)=气体总压(P)×体积分数]。
(4)氮氧化物也可以用尿素[(NH2)2CO]水溶液吸收。用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为___________________________________。
(5)汽车尾气吸收还可利用反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正= k正·c2(NO)·c2(CO),v逆= k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正= k正·c2(NO)·c2(CO),v逆= k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的恒容密闭容器中充入1 molCO和1 mol NO,在一定温度下达到平衡时,CO的转化率为80%,则k正︰k逆=_____L/mol。
-
“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)==NH4HSO3(aq) △H1=akJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq)==(NH4)2SO3(ag)+H2O(l) △H2=bkJ·mol-1;
③2(NH4)2SO3(aq)+O2(g)==2(NH4)2SO4(aq) △H3=ckJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)==2(NH4)2SO4(aq)+2H2O(1)的△H=___________kJ·mol-1。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)===2CaSO4(s)+2CO2(g)
△H=-681.8kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)___________mol·L-1·min-1;当升高温度,该反应的平衡常数K___________(填“增大”“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___________(填字母)。
A加入一定量的粉状碳酸钙 B通入一定量的O2
C适当缩小容器的体积 D加入合适的催化剂
(3) NOx的排放主要来自于汽车尾气,有人利用反应
C(s)+2NO(g) N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为____________________;在1100K时,CO2的体积分数为___________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___________[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数___________(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则 =___________。
=___________。
-
“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)==NH4HSO3(aq) △H1=akJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq)==(NH4)2SO3(ag)+H2O(l) △H2=bkJ·mol-1;
③2(NH4)2SO3(aq)+O2(g)==2(NH4)2SO4(aq) △H3=ckJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)==2(NH4)2SO4(aq)+2H2O(1)的△H=___________kJ·mol-1。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)===2CaSO4(s)+2CO2(g)
△H=-681.8kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)___________mol·L-1·min-1;当升高温度,该反应的平衡常数K___________(填“增大”“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___________(填字母)。
A加入一定量的粉状碳酸钙 B通入一定量的O2
C适当缩小容器的体积 D加入合适的催化剂
(3) NOx的排放主要来自于汽车尾气,有人利用反应
C(s)+2NO(g) N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
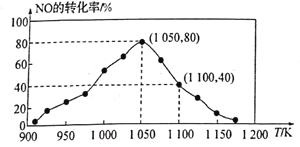
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为____________________;在1100K时,CO2的体积分数为___________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___________[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数___________(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则 =___________。
=___________。
-
“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq) = NH4HSO3(aq) ΔH1=a kJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq) = (NH4)2SO3(aq)+H2O(l) ΔH2=b kJ·mol-1;
③2(NH4)2SO3(aq)+O2(g) = 2(NH4)2SO4(aq) ΔH3=c kJ·kJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l) 的ΔH=________kJ·mol-1
(2)燃煤发电厂常利用反应:2CaCO3(s)+2SO2(g)+O2(g) = 2CaSO4(s)+2CO2(g) ΔH=-681.8 kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)=________mol·L-1·min-1;当升高温度,该反应的平衡常数K________(填“增大”“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________(填字母)。
A.加入一定量的粉状碳酸钙 B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH=-34.0 kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________;在1100K时,CO2的体积分数为________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=________[已知:气体分压(P分)=气体总压(P总)×体积分数]。
(5)工业上常用高浓度的 K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:
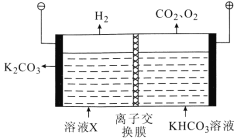
①在阳极区发生的反应包括___________和H++HCO3- =CO2↑+H2O
②简述CO32-在阴极区再生的原理:______________。
-
“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)亚硝酰氯(Cl—N=O)气体是有机合成的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为__。
相关化学键的键能如下表所示:
| 化学键 | Cl—Cl | N O(NO气体) O(NO气体) | Cl—N | N=O |
| 键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(CO2)=___mol·L-1·min-1;当升高温度,该反应的平衡常数K__(填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是__(填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为__。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=__[已知:气体分压(P分)=气体总压(Pa)×体积分数]
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅降低温度,k正减小的倍数_(填“>”、“<”或“=”)k逆减小的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则 =__(计算结果用分数表示)
=__(计算结果用分数表示)
-
“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)△H=-681.8kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
0~10min内,平均反应速率υ(O2)__ mol·L-1·min-1;当升高温度,该反应的平衡常数K_____(填“增大”“减小”或“不变”)。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
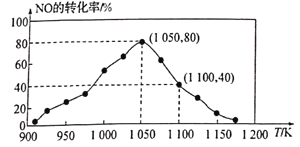
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为__________;在1100K时,CO2的体积分数为_____。
(3)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___ [已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,υ正=k正·c2(NO)·c2(CO),υ逆=k逆·c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,υ正=k正·c2(NO)·c2(CO),υ逆=k逆·c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数___(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则 =_____。
=_____。
-
“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)===2NO(g) ΔH1= +180.5 kJ/mol
C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
2C(s)+O2(g)===2CO(g) ΔH3=-221 kJ/mol
若某反应的平衡常数表达式为K=[c(N2)·c2(CO2)]/[c2(NO)·c2(CO)],则此反应的热化学方程式为:_____________。
(2)N2O5在一定条件下可发生分【解析】
2N2O5(g) 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=________。2~5 min内用NO2表示的该反应的平均反应速率为________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________(用k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________(用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
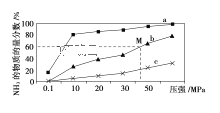
①曲线a对应的温度是________。
②M点对应的H2的转化率是________。
(5)常温下,联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的电离平衡常数值_______________。(已知:N2H4+H+ N2H5+的K=8.7×107 Kw=1.0×10-14)
N2H5+的K=8.7×107 Kw=1.0×10-14)
-
“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H1= +180.5 kJ/mol
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H3=-221 kJ/mol
若某反应的平衡常数表达式为:K= [c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为____________________________________。
(2)N2O5在一定条件下可发生分【解析】
2N2O5(g) 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
| t/ min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/<mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=__________。2~5 min内用NO2表示的该反应的平均反应速率为__________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__________。(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用 k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用 k正、k逆表示)。
(4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200℃、400℃、600℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
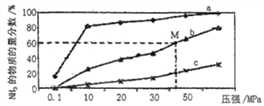
①曲线a对应的温度是__________。
②M点对应的H2的转化率是__________。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:______________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8。)
-
“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H1= +180.5 kJ/mol
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H3=-221 kJ/mol
若某反应的平衡常数表达式为:K= [c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为____________________________________。
(2)N2O5在一定条件下可发生分【解析】
2N2O5(g) 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
| t/ min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/<mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=__________。2~5 min内用NO2表示的该反应的平均反应速率为__________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__________。(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用 k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用 k正、k逆表示)。
(4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200℃、400℃、600℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
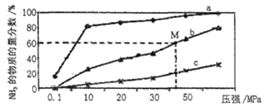
①曲线a对应的温度是__________。
②M点对应的H2的转化率是__________。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:______________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8。)
-
“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(I)汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:



若某反应的平衡常数表达式为 ,则此反应的热化学方程式为_______。
,则此反应的热化学方程式为_______。
(2) 在一定条件下可发生分【解析】
在一定条件下可发生分【解析】
 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
a.  和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c.  d. 气体的密度保持不变
d. 气体的密度保持不变
(Ⅱ)甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。 CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(3)将 和
和 按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成
按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
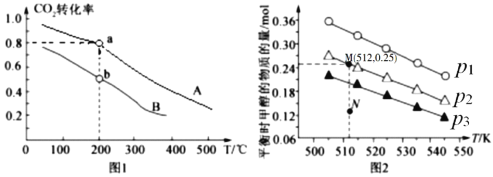
①a、b两点化学反应速率分别用 ,表示,则
,表示,则 _____
_____ (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
②列出a点对应的平衡常数表达式K= ____________________。
(4)在1.0 L恒容密闭容器中投入1 mol  和2.75 mol
和2.75 mol  发生反应:CO2(g) + 3H2(g)
发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为
D.在 及512 K时,图中N点
及512 K时,图中N点
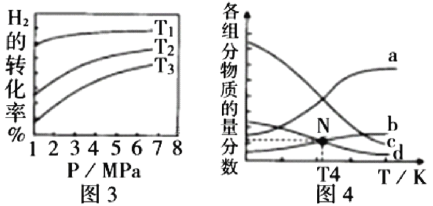
(5) 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)  C2H5OH(g) + 3H2O(g)
C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即 。
。
① 图3中投料比相同,温度 ,则该反应的焓变
,则该反应的焓变 _______0(填
_______0(填 )。
)。
② m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式)。
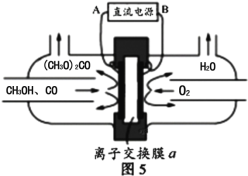
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。离子交换膜a为 ______(填“阳膜”、“阴膜”),阳极的电极反应式为_______________________________________
2CaSO4(s)+2CO2(g) ΔH =−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。

N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正= k正·c2(NO)·c2(CO),v逆= k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。











