-
关于英文称呼中国为“CHINA”一词的来历,一种说法是来源于瓷器,因为在英语中中国和瓷器都是“CHINA”。下列关于瓷器的说法正确的是
A.中国是“瓷器之乡”、传统瓷器属于硅酸盐产品
B.瓷器的主要成分是黏土
C.瓷器的烧制过程属于物理变化
D.因为瓷器是硅酸盐,所以难溶于水
难度: 简单查看答案及解析
-
下列叙述正确的是
A.钠燃烧后得到白色的过氧化钠
B.单晶硅可作为光伏电池的材料
C.除去表面氧化膜的铝片在酒精灯上加热会剧烈燃烧
D.新制氯水使pH试纸先变红后褪色,说明其中含HCl和Cl2
难度: 简单查看答案及解析
-
下列有关实验的操作或方法正确的是
A.用洁净的铂丝蘸取碳酸钾溶液进行灼烧,直接观察钾的焰色反应
B.实验室通过加热NH4Cl固体的方法制备NH3
C.用过滤的方法可以分离Na2CO3和Na2SO4
D.实验室通过蒸馏的方法制取蒸馏水
难度: 简单查看答案及解析
-
常温常压下,下列各组气体既能大量共存又能用浓硫酸干燥的是
A.NO、O2、N2 B.HCl、H2、O2
C.NH3、O2、CO2 D.CO2、H2S、SO2
难度: 简单查看答案及解析
-
下列物质可保持在带橡胶塞的无色细口玻璃瓶的是
A.金属钠 B.氢氟酸 C.浓硫酸 D.碳酸钠溶液
难度: 简单查看答案及解析
-
设NA表示阿伏伽德罗常数的值,下列叙述正确的是
A.0.1mol Fe与100mL 1mol·L-1盐酸充分反应,溶液中的Fe2+数目为0.1NA
B.0.1mol·L-1(NH4)2SO4溶液中含SO42-数目为0.1NA
C.常温常压下,1.8g H2O中含有的分子数为0.1NA
D.33.6LNO2和足量水反应转移的电子数为NA
难度: 简单查看答案及解析
-
向含有Fe2+、Al3+、NO3-、NH4+的溶液中先加入过量金属钠,有气体和沉淀生成,然后再加入过量的稀硝酸使沉淀溶解,最终离子数一定不变的是
A.Fe2+ B.Al3+ C.NO3- D.NH4+
难度: 中等查看答案及解析
-
下列事实所涉及的离子方程式正确的是
A.FeCl2溶液用于腐蚀印刷电路铜板:2Fe3++3Cu= Fe+3Cu2+
B.汉代著作里记载“石胆能化铁为铜”:Cu2++Fe= Fe2++Cu
C.稀硝酸可以溶解铜:Cu+4H++ NO3-= Cu2++2H2O+NO↑
D.盐酸除去铜表面的铜绿:Cu2(OH)2CO3+4H+= 2Cu2++2H2O+CO2↑
难度: 简单查看答案及解析
-
实验室中用图1所示的装置进行氨气的喷泉实验,实验结束后的情况如图2所示,下列说法正确的是

A.需要用热毛巾覆盖烧瓶底引发喷泉实验
B.红色溶液未充满是因为装置漏气
C.烧瓶中溶液呈红色是因为氨气能电离出OH-
D.若在标准状况下进行该实验,得到氨水的浓度是1/22.4mol·L-1
难度: 简单查看答案及解析
-
将SO2和CO2的混合物气体通入下列物质的溶液中,一定产生沉淀的是
A.CaCl2 B.NH3 C.FeCl3 D.Ba(NO3)2
难度: 简单查看答案及解析
-
通过一步不能实现如图所示转化关系的一组物质是
选项
X
Y
Z
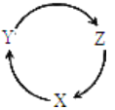
A
Si
SiO2
H2SiO3
B
CO2
Na2CO3
NaHCO3
C
SO2
SO3
H2SO4
D
NO
NO2
HNO3
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
Mg(OH)2是常用的阻燃材料。以白云石(CaCO3、MgCO3的混合物)为原料制备Mg(OH)2和CaCO3的工艺流程如下:

下列说法不正确的是
A.酸溶生成Mg2+的离子方程式是:MgCO3+2H+= Mg2++CO2↑+H2O
B.流程中可以循环利用的物质是CO2
C.酸溶过程中盐酸可用稀硝酸或硫酸代替
D.流程中没有涉及氧化还原反应
难度: 简单查看答案及解析
-
在指定条件和相应的计量下,甲物质能与乙物质恰好都能完全反应的是
选项
甲
乙
条件
A
1L0.4 mol·L-1氨水
含0.12molAlCl3的AlCl3溶液
常温常压
B
0.9g Al
50 mL18.4 mol·L-1H2SO4溶液
常温
C
2.24L SO2
含0.1molNaOH的NaOH溶液
标准状况
D
1mL Cl2
5mL H2O
常温、避光
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列离子在无色溶液中能大量共存,且加入铝粉一定可以产生H2的一组是
A.NH4+、Fe3+、SO42-、Cl- B.Na+、H+、AlO2-、Cl-
C.Mg2+、H+、SO42-、NO3- D.Ba2+、K+、OH-、Cl-
难度: 简单查看答案及解析
-
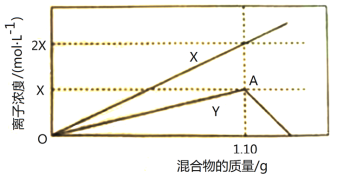
某同学向100mL NH4Al(SO4)2溶液中加入0.1 mol·L-1NaOH溶液,产生沉淀的图像如下:

下列说法不正确的是
A.NH4Al(SO4)2溶液中含0.003 mol Al3+
B.NH4Al(SO4)2溶液中NH4+的浓度是0.01 mol·L-1
C.Al3+结合OH-的能力比NH4+强
D.Y点之后发生反应的离子方程式是:Al(OH)3+ OH-= AlO2-+2H2O
难度: 简单查看答案及解析
-
一定质量的某铁的氧化物FexOy与100mL 0.1 mol·L-1 稀硫酸恰好反应完全,得到溶液Z。若用相同质量的该铁的氧化物与CO或H2在高温下反应,反应需要标准状况下CO或H2的体积分别为V1和V2。下列说法正确的是
A.x=2、y=3 B.Z溶液一定能使酸性KMnO4溶液褪色
C.V1=V2 D.V1和V2的体积不能确定
难度: 中等查看答案及解析