-
2017年11月5 日,长征三号乙运载火箭将两颗北斗三号全球导航卫星送入太空轨道。下列有关说法正确的是( )
A. 火箭燃料燃烧时将化学能转化为热能 B. 火箭燃料中的四氧化二氮属于化石燃料
C. 火箭箭体采用铝合金是为了美观耐用 D. 卫星计算机芯片使用的是高纯度的二氧化硅
难度: 中等查看答案及解析
-
某溶液仅有 K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-中的几种.为确定其成分,做如下实验:
①取部分溶液.加入适量 Na2O2 固体,产生无色无味的气体和白色沉淀,再加入足量的 NaOH 溶液后白色沉淀全部溶解;
②另取部分溶液,加入 HNO3 酸化的Ba(NO3)2溶 液,无沉淀产生。下列推断正确的是
A. 肯定有 Al3+、Cl-,一定没有 HCO3-和SO42-
B. 肯定有 Al3+、Mg2+、Cl-,可能有NH4+、K+
C. 肯定有 Al3+、NH4+、Cl-,肯定没有HCO3-
D. 该溶液可能显弱酸性,也可能显中性
难度: 困难查看答案及解析
-
化学与我们的生活息息相关,下列说法正确的是( )
A.红宝石、玛瑙、水晶、钻石的主要成分都是硅酸盐
B.电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
C.“霾尘积聚难见路人”,雾霾所形成的气溶胶没有丁达尔效应
D.鸟巢使用了高强度、高性能的钒氮合金高新钢,铁合金熔点、硬度均比纯铁高
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法错误的是( )
A.98g H2SO4含有2 NA个H+和NA个SO42-
B.100mL 0.1mol·L−1的Na2CO3溶液中,含阴离子的数目大于0.01NA
C.32g O2和O3的混合物中含有的氧原子数目为2NA
D.标准状况下,0.56L丙烷中含有共价键的数目为0.25NA
难度: 简单查看答案及解析
-
在水溶液中能大量共存的一组离子是( )
A.Na+、Ca2+、Cl-、SO42- B.Fe2+、H+、HCO3-、Cl-
C.Mg2+、NH4+、Cl-、SO42- D.K+、Fe3+、NO3-、OH-
难度: 简单查看答案及解析
-
用下面的方案进行某些离子的检验,其中方案设计严密的是( )
A.检验试液中的SO42-:试液
无沉淀
白色沉淀
B.检验试液中的Fe2+:试液
无明显现象
红色溶液
C.检验试液中的CO32-:试液
白色沉淀
沉淀溶解
D.检验试液中的I-:试液
无明显现象
蓝色溶液
难度: 简单查看答案及解析
-
下列关于物质的分类中,正确的是( )
酸性氧化物
酸
盐
混合物
电解质
A
SiO2
HClO
烧碱
CuSO4·5H2O
CO2
B
Na2O2
HNO3
NaHSO4
漂白粉
Mg
C
SO3
H2SiO3
纯碱
水玻璃
NaCl
D
NO
Al(OH)3
BaCO3
水泥
NH3
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
X、Y、Z是三种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A.元素非金属性由弱到强的顺序为X<Y<Z
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.三种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
难度: 中等查看答案及解析
-
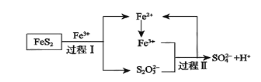
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2Cr2O7溶液,发生的两个化学反应为①SO2+2Fe3++2H2O→
+2Fe2++W,②
+aFe2++bH+→Cr3++Fe3++H2O。下列有关说法正确的是
A.还原性:Cr3+>SO2 B.方程式②中,a=6,b=7
C.
能将Na2SO3氧化成Na2SO4 D.方程式①中W为OH−
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A. Ba(OH)2溶液与稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4+H2O
B. 向NaOH溶液中通入过量的SO2气体:2OH-+SO2=SO32-+H2O
C. NaHCO3和Ca(OH)2溶液按物质的量比1:2混合:Ca2++HCO3-+OH-=CaCO3↓+H2O
D. 向FeBr2中通入过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
难度: 中等查看答案及解析
-
下列除杂质的方法不正确的是
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.FeCl3溶液中混有少量AlCl3:加入过量的氨水,过滤洗涤沉淀,将沉淀再用适量盐酸溶解
C.Fe2O3中混有少量Al2O3:加入过量NaOH溶液充分反应,过滤、洗涤、干燥
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
难度: 中等查看答案及解析
-
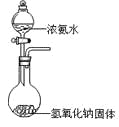
某课外实验小组设计的下列实验不合理的是 ( )
A. 制备并观察氢氧化亚铁

B. 证明过氧化钠与水反应放热
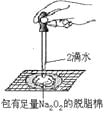
C. 制备并收集少量NO2气体

D. 实验室制备少量氨气
难度: 困难查看答案及解析
-
下列化学用语中,错误的是( )
A.镁离子的结构示意图为

B.Na2O2的电子式为
C.氯化氢分子的形成过程可用电子式表示为
D.次氯酸的结构式为H-Cl-O
难度: 中等查看答案及解析
-
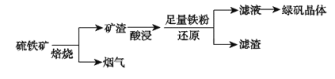
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下,下列说法错误的是
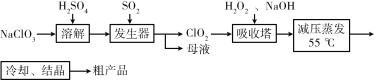
A. NaClO3在发生器中作氧化剂
B. 吸收塔中1mol H2O2得到2mol电子
C. 吸收塔中温度不宜过高,会导致H2O2的分解
D. 从“母液”中可回收的主要物质是Na2SO4
难度: 中等查看答案及解析
-
已知X、Y、Z为三种短周期主族元素,可分别形成Xn+、Ym+、Zn-三种离子,已知m>n且X、Y、Z三种原子的M层电子数均为奇数。下列说法中不正确的是( )
A.三种离子中,Ym+的离子半径最小
B.Z的最高价氧化物对应水化物的分子式为HnZO4
C.X、Y、Z三种元素最高价氧化物对应水化物的碱性依次增强
D.三种元素相应的最高价氧化物对应水化物之间两两会发生反应
难度: 中等查看答案及解析
-
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,芳香化合物a、b、c是合成轮烷的三种原料,其结构如下图所示。下列说法不正确的是
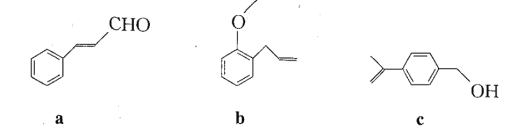
A.b、c互为同分异构体
B.a、c分子中所有碳原子均有可能处于同一平面上
C.a、b、c均能发生氧化反应、加成反应、加聚反应和酯化反应
D.a、b、c均能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
难度: 中等查看答案及解析
-
甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法正确的是( )
A. 若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物
B. 若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应
C. 若丙、丁混合产生大量白烟,则乙可能会使高锰酸钾溶液褪色
D. 若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
难度: 困难查看答案及解析
-
下列事实不能用化学平衡移动原理解释的是
A.收集氯气可以用排饱和食盐水的方法
B.在一定条件下,氢气与碘蒸汽反应达平衡后,加压,混合气体颜色变深
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率
难度: 中等查看答案及解析
-
已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10 个电子。它们之间转化关系如下图所示。下列说法正确的是
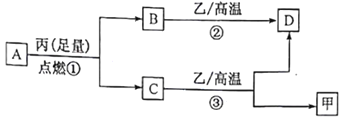
A. 原子半径:Z>Y>X
B. X与Y形成的化合物只含极性键
C. Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D. 气态氢化物的稳定性:A<C
难度: 中等查看答案及解析
-
某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
实验1
实验2
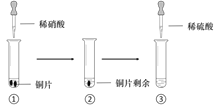
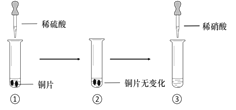
①、③中溶液呈蓝色,试管口有红棕色气体产生
③中溶液呈蓝色,试管口有红棕色气体产生
下列说法正确的是
A.稀硝酸一定被还原为NO2
B.实验1-②中溶液存在:c(Cu2+) + c(H+) =c(NO3-) + c(OH-)
C.由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D.实验1-③、实验2-③中反应的离子方程式:3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O
难度: 困难查看答案及解析
-
下列实验操作和现象及所得出的结论都正确的是
选项
实验操作和现象
结论
A
向BaCl2溶液中通入SO2,产生白色沉淀
BaSO3是不溶于水的白色固体
B
向蓝色石蕊试纸上滴加新制氯水,试纸边缘呈红色,中间为白色
氯水既有酸性又有还原性
C
相同条件下,分别测量0.1mol·L-1和0.01mol·L-1醋酸溶液的导电性,前者的导电性强
醋酸浓度越大,电离程度越大
D
取5mL 0.1mol·L-1KI溶液,加入1mL 0.1mol·L-1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色
Fe3+与I-所发生的反应为可逆反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关溶液中粒子浓度的关系式中,正确的是( )
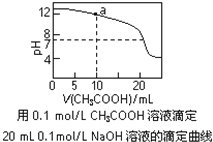
A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
D.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
难度: 困难查看答案及解析
-
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是( )
A.可用铁做阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2Cl-+2e-=Cl2↑
D.1 mol 二价镍全部转化为三价镍时,外电路中通过了1 mol 电子
难度: 简单查看答案及解析
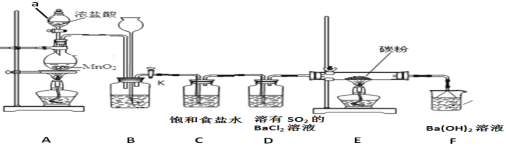
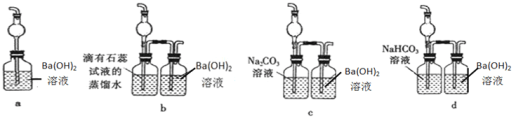
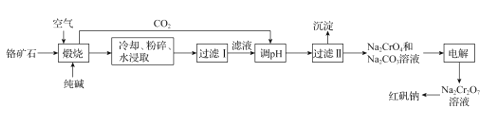
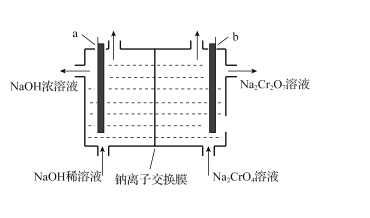
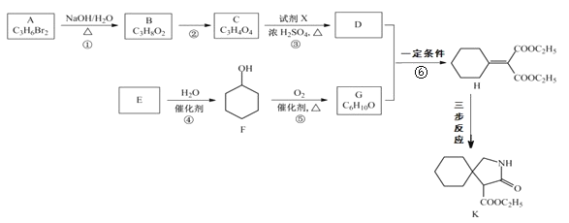
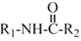 +C2H5OH
+C2H5OH