-
改革开放40年,“发展与保护”的方针使我国在取得了很多世界瞩目的科技成果的同时,文物也得到了很好的保护。下列说法不正确的是( )




A.蛟龙号潜水器用到钛合金,22号钛元素属于过渡元素
B.港珠澳大桥水下钢柱镶锌块的防腐方法为牺牲阳极的阴极保护法
C.除锈剂使有锈迹的银器见新,是化学变化
D.变形的金属香炉整形复原,是化学变化
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列说法或有关化学用语的表达正确的是
A.1s电子云呈球形,表示电子绕原子核做圆周运动
B.钠原子由1s22s22p63p1→ls22s22p63p1时,原子释放能量,由基态转化成激发态
C.因氧元素的电负性比氮元素的大,故氧原子的第一电离能比氮原子的大
D.基态Fe原子的外围电子排布图为
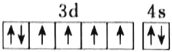
难度: 简单查看答案及解析
-
化学与社会、生活密切相关,对下列现象或事实的解释正确的是( )
现象或事实
解释
A
用热的纯碱溶液去油污
Na2CO3可直接与油污反应
B
漂白粉在空气中久置变质
漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
C
施肥时,草木灰(主要成分K2CO3)不能与NH4Cl混合使用
K2CO3与NH4Cl在潮湿的土壤中会反应生成氨气,降低肥效
D
FeCl3溶液可用于铜质印刷线路板制作
Cu能从FeCl3溶液中把铁还原为游离态
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LSO3含有的氧原子个数为1.5NA
B.100g34%的双氧水中含有H—O键的数目为2NA
C.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
D.16.8gFe粉与足量水蒸气完全反应,转移的电子数目为0.8NA
难度: 中等查看答案及解析
-
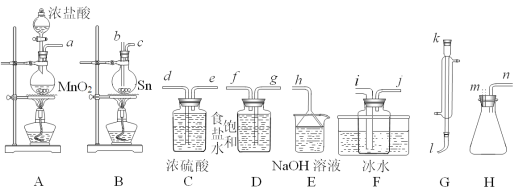
实验室模拟工业上侯德榜制碱原理制备纯碱,下列操作未涉及的是
A.
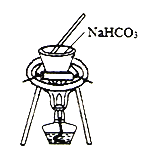 B.
B. 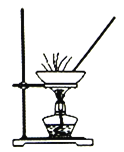 C.
C. 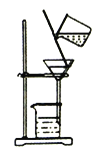 D.
D. 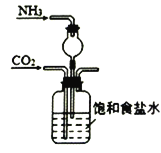
难度: 中等查看答案及解析
-
下列解释实验事实的方程式不正确的是( )
A.用Na2S处理含Hg2+的废水:Hg2++S2-=HgS↓
B.向沸水中滴加饱和氯化铁溶液得到红褐色液体:FeCl3+3H2O=Fe(OH)3(胶体)+3HCl
C.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2FeCl3=2Fe(OH)3+3MgCl2
D.Na2O2加入H218O中:2Na2O2+2H2l8O=4Na++4OH-+18O2↑
难度: 中等查看答案及解析
-
下列实验过程不能达到实验目的的是( )
实验目的
实验过程
A
探究维生素C的还原性
向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
B
配制100mL1.0mol/L CuSO4溶液
将25.0gCuSO4·5H2O配成100mL溶液
C
验证X溶液中是否含有Fe2+
向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,观察溶液颜色变化
D
除去固体KNO3中少量的NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤、洗涤、干燥
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol•L-1FeCl3溶液:Na+、ClO-、SO42-、CO32-
B.0.1mol•L-1NaOH溶液:K+、NO3-、Br-、SiO32-
C.0.1mol•L-1Ba(OH)2溶液:Al3+、NH4+、NO3-、HCO3-
D.0.1mol•L-1KI溶液:Mg2+、NH4+、MnO4-、Cl-
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeS2
SO2
H2SO4
B.N2
NH3
NO
NO2
HNO3
C.Fe
FeCl2
FeCl3
Fe(OH)3
D.MnO2
Cl2
漂白粉
难度: 中等查看答案及解析
-
下列除杂方案错误的是
选项
被提纯的物质
杂质
除杂试剂
除杂操作
A
MgO(s)
Al2O3(s)
NaOH溶液
过滤
B
FeCl2(aq)
FeCl3(aq)
Fe屑
过滤
C
NaHCO3 (aq)
Na2CO3(aq)
Ca(OH)2溶液
过滤
D
CuO(s)
Cu(s)
O2
加热
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
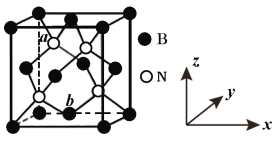
短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是( )
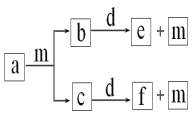
A.简单离子半径:Z<Y
B.简单气态氢化物的热稳定性:Y>X
C.阴离子的还原性:Y>W
D.W2Y2中含有非极性键
难度: 中等查看答案及解析
-
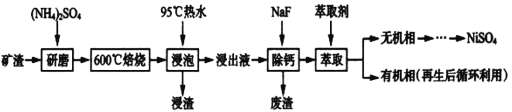
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
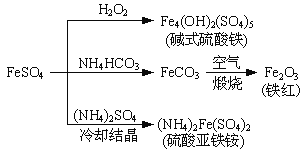
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
难度: 中等查看答案及解析
-
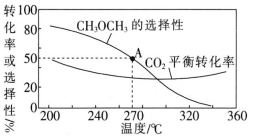
电解质溶液电导率越大导电能力越强。常温下用0.100mol·L-1盐酸分别滴定10.00mL浓度均为0.100mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH·H2O]=1.6×10-4。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
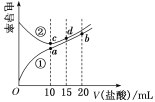
A.曲线②代表滴定二甲胺溶液的曲线
B.a点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
C.d点溶液中:2c(Na+)=3c(Cl-)
D.在相同温度下,a、b、c、d四点的溶液中,水的电离程度最大的是c点
难度: 中等查看答案及解析
-
科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,下列说法正确的是( )
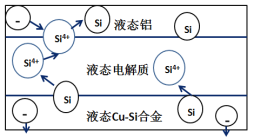
A.电子由液态Cu-Si合金流出,流入液态铝电极
B.三层液熔盐的作用是使电子能够在三层间自由流动
C.在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
D.液态铝电极与正极相连,作为电解池的阳极
难度: 中等查看答案及解析
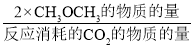 ×100%。
×100%。