-
随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程上,其首要原因是( )
A. 利用电池外壳的金属材料
B. 回收其中石墨电极
C. 防止电池中汞、镉和铅等重金属离子对水和土壤的污染
D. 不使电池中泄漏的电解液腐蚀其他物品
难度: 简单查看答案及解析
-
已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
难度: 中等查看答案及解析
-
一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)
2Z(g) 一定达到化学平衡状态的是( )
①容器中气体的密度不再发生变化 ② X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.②③ C.③④ D.①④
难度: 中等查看答案及解析
-
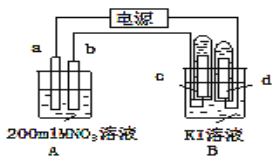
在三个烧杯中分别盛有海水,依次插入(1)铁片;(2)导线相连的铜、铁片;(3)导线相连的锌、铁片、铁在其中被腐蚀时由快到慢的顺序是
A.(1)(2)(3) B.(2)(3)(1)
C.(2)(1)(3) D.(3)(2)(1)
难度: 中等查看答案及解析
-
铜锌原电池(如图)工作时,下列叙述错误的是( )
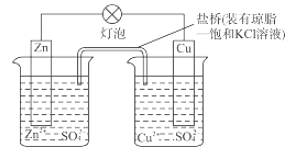
A.正极反应为:Cu2++2e–= Cu
B.电池反应为:Zn+Cu2+=Zn2+ +Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
难度: 中等查看答案及解析
-
一定条件下的密闭容器中,进行如下反应:NO(g)+CO(g)
1/2N2(g)+CO2(g) ΔH=-373.2 kJ/mol,为提高该反应的反应速率,缩短达到平衡的时间,下列措施不可取的是
A.加(正)催化剂 B.增大压强(体积减小)
C.给体系加热 D.从体系中不断移去部分CO2
难度: 中等查看答案及解析
-
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-) = 0.1 mol·L-1
C.c(C2O42-) < c(H2C2O4)
D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
难度: 中等查看答案及解析