-
下列说法不正确的是
A.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)
Mg2+(aq)+2OH—(aq)
B.NaHS溶液中存在电离平衡:HS—+H2O
H2S+OH-
C.NaHCO3溶液中存在水解平衡:HCO3—+H2O
OH—+H2CO3
D.反应:Cr2O72—+ H2O
2CrO42—+2H+,其平衡常数K=
难度: 中等查看答案及解析
-
能在水溶液中大量共存的一组离子是
A.H+、I-、NO3-、CO32- B.NH4+、Fe3+、OH-、Br-
C.K+、Cl-、Cu2+、NO3- D.Al3+、SO42-、Na+、S2-
难度: 中等查看答案及解析
-
下列有关实验说法正确的是
A.用托盘天平称量NaOH固体时,直接放在纸上称量
B.滴定管用蒸馏水洗净后,直接注入标准液进行滴定,滴定结果将偏高
C.氨水滴定盐酸时,用酚酞作指示剂
D.用玻璃棒蘸取溶液滴在润湿的pH试纸上测其pH
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
选项
热化学方程式
结论
A
2H2(g)+O2(g)=2H2O(g) △H=—483.6 kJ/mol
H2的燃烧热为241.8 kJ/mol
B
OH—(aq)+H+(aq)= H2O(g) △H=—57.3 kJ/mol
含1mol NaOH的稀溶液与浓H2SO4完全中和,放出热量小于57.3 kJ
C
2C(s)+2O2(g)=2CO2(g) △H=—a kJ/mol
2C(s)+O2(g)=2CO(g) △H=—b kJ/mol
b<a
D
C(石墨,s)=C(金刚石,s) △H=+1.5 kJ/mol
金刚石比石墨稳定
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符的是
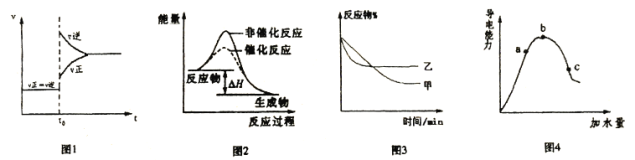
A.图1表示A(g)+B(g)
3C(g)+2D(s) △H<0,达到平衡后升高温度成增大压强时的速率—时间变化图像
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示压强对可逆反应A(g)+B(g)
3C(g)+D(s)的影响,乙的压强大
D.图4表示冰醋酸加水稀释,导电能力的变化图像,其中b点醋酸电高程度最大
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH-;△H>0,下列叙述正确的是
A.向水中加入少量固体NaHSO4,c(H+)增大,KW不变
B.向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)降低
C.向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.室温下,向0.1 mol/L的 CH3COOH溶液中加入少量水,溶液中所有离子浓度都降低
D.将Ca(ClO)2、CaSO4、FeCl3溶液蒸干均得不到原溶液
难度: 中等查看答案及解析
-
为增强铝的耐腐蚀性,现以铅蓄电池为外电源(左池),以Al作阳极、Pb作阴极,电解稀硫酸(右池),使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O
Al2O3+3H2↑。
关闭K,电解过程中,以下判断正确的是
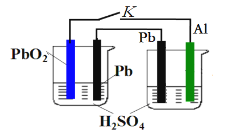
A.两池中H+均移向Pb电极
B.左池每消耗3 mol Pb,右池生成2 mol Al2O3
C.左池Pb电极质量增加,右池Pb电极质量不变
D.左池正极反应:PbO2+4H++2e-=Pb2++2H2O
难度: 中等查看答案及解析
-
常温下,下列说法正确的是
A.CH3COOH溶液中:c(CH3COOH)=c(OH—)+c(CH3COO—)
B.pH=2的HCl与等体积0.01 mol/L CH3COONa混合后,溶液中c(Cl—)=c(CH3COO—)
C.氨水中通入过量CO2后,溶液中c(H+)+c(NH4+)=c(OH—)+c(HCO3—)
D.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)>c(HCO3—)
难度: 中等查看答案及解析
-
下列实验操作、对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
往1mL 0.1mol/L AgNO3溶液中滴入2滴0.1 mol/L 的NaCl溶液,再往混合溶液中滴入2滴0.1 mol/L KI溶液,充分振荡
先产生白色沉淀,后出现黄色沉淀
Ksp(AgCl) >Ksp (AgI)
B
一定条件下,密闭容器反应达平衡:
H2(g)+I2(g)
2HI(g),缩小容器体积
气体颜色加深
平衡逆移
C
等体积、等pH的HA和HB两种酸溶液分别与足量的大小相同的锌反应
反应开始后HA产生H2的速率更快
HA是弱酸
D
向锌粒与稀硫酸反应的试管中滴加几滴CuSO4溶液
产生气体的速率明显加快
CuSO4对该反应有催化作用
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)
CO(g)+3H2(g)。设起始
=Z,在恒压下,平衡时
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
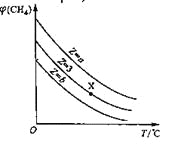
A.该反应的焓变ΔH<0
B.图中Z的大小为b>3>a
C.图中X点对应的平衡混合物中
=3
D.温度不变时,图中X点对应的平衡在加压后
(CH4)减小
难度: 困难查看答案及解析
-
一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)⇌2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.叙述正确的是( )

A.温度T℃下,该反应的平衡常数K=
B.温度T℃下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b改变的条件是温度,则该反应△H<0
难度: 中等查看答案及解析
-
将0.2mol/L HCN溶液合0.1mol/L的NaOH溶液等体积混合后,c(Na+)>c(CN—),下列说法正确的是
A.c(HCN)= c(CN—) B.溶液显酸性
C.c(HCN)- c(CN—)= c(OH—) D.c(HCN)+ c(CN—)=2 c(Na+)
难度: 中等查看答案及解析
-
室温下,用0.100 mol·L-1NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
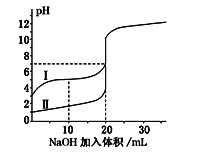
A. Ⅰ表示的是滴定盐酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C. V(NaOH)=20mL时,两份溶液中c(Cl-)=c(CH3COO-)
D. V(NaOH)=10mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是

A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313 K时Ksp(SrSO4)最大
C.283 K时,图中a点对应的溶液是饱和溶液
D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
难度: 中等查看答案及解析