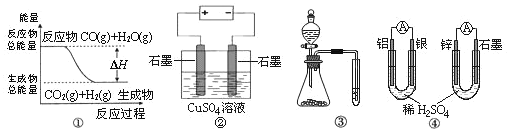
-
物质的量浓度相同的以下溶液:①NH4HSO4 ②(NH4)2CO3 ③NH4Fe(SO4)2 ④NH4NO3 ⑤CH3COONH4,c(NH4+)由大到小的顺序为
A. ②①③④⑤ B. ③①④②⑤ C. ①③④⑤② D. ②①④⑤③
难度: 中等查看答案及解析
-
工业酸性废水中的Cr2O72﹣可转化为Cr3+除去,实验室用电解法模拟该过程,结果如表所示(实验开始时溶液体积为50mL,Cr2O72﹣的起始浓度、电压、电解时间均相同).下列说法中,不正确的是
实验
①
②
③
电解条件
阴、阳极均为石墨
阴、阳极均为石墨,滴加1mL浓硫酸
阴极为石墨,阳极为铁,滴加1mL浓硫酸
Cr2O72﹣的去除率/%
0.922
12.7
57.3
A. 对比实验①②可知,降低pH可以提高Cr2O72﹣的去除率
B. 实验②中,Cr2O72﹣在阴极放电的电极反应式是Cr2O72﹣+6e﹣+14H+═2Cr3++7H2O
C. 实验③中,Cr2O72﹣去除率提高的原因是Cr2O72﹣+6 Fe2++14H+═2Cr3++6Fe3++7H2O
D. 实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O72﹣被还原
难度: 中等查看答案及解析
-
人类在未来将逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法错误的是:
A. 煤、石油和天然气都属于碳素燃料
B. 发展太阳能经济有助于减缓温室效应
C. 太阳能电池可将太阳能直接转化为电能
D. 目前研究菠菜蛋白质“发电”不属于“太阳能文明”
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.含有大量Al3+的溶液中:K+、Mg2+、NO3-、HCO3-
B.与铝粉反应放出氢气的无色溶液中:NO3﹣、Mg2+、Na+、SO42﹣
C.常温下由水电离出的c(H+)=10-13 mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-
D.Kw/c(H+) =10-13 mol·L-1溶液中:Fe3+、NH4+、Mg2+、SO42-
难度: 中等查看答案及解析
-
某元素基态原子4s轨道上有1个电子,则该基态原子价电子排布不可能是( )
A. 3p64s1 B. 4s1 C. 3d54s1 D. 3d104s1
难度: 简单查看答案及解析
-
下列说法正确的是
A.将NaOH溶液分多次缓慢注入盐酸中,还是一次性快速注入盐酸中,都不影响中和热测定
B.已知反应的中和热为ΔH=-57.3 kJ·mol-1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热ΔH=-2×57.3 kJ·mol-1
C.燃烧热是指在101 kPa时可燃物完全燃烧时所放出的热量,故S(s)+3/2O2(g)=SO3(g)ΔH=-315 kJ·mol-1即为硫的燃烧热
D.已知冰的熔化热为6.0 kJ·mol-1,冰中氢键键能为20.0 kJ·mol-1,假设1 mol冰中有2 mol氢键,且熔化热完全用于破坏冰中的氢键,则最多只能破坏1 mol冰中15%氢键
难度: 中等查看答案及解析
-
pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
A.9:1 B.1:11 C.1:9 D.11:1
难度: 简单查看答案及解析
-
X、Y、Z、M、W、N六种元素的原子序数依次增大,其中X、Y、Z、M、W为五种短周期元素。X元素的某种核素无中子,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示,N是用量最多的金属元素。下列说法不正确的是
Y
Z
M
W
A.原子半径:W>Y>Z>M>X
B.N的一种氧化物可用作油漆和涂料
C.氢化物的沸点:Z小于M
D.工业上制备W单质的方法为电解熔融的W的氧化物
难度: 困难查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A. 第一电离能:③>②>① B. 原子半径:③>②>①
C. 电负性:③>②>① D. 最高正化合价:③>②>①
难度: 简单查看答案及解析
-
具有下列电子层结构的原子,其对应元素一定属于同一周期的是
A. 两种原子的电子层上全部都是s电子
B. 3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子
C. 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子
D. 原子核外M层上的s能级和p能级都填满了电子,而d轨道上尚未有电子的两种原子
难度: 中等查看答案及解析
-
在一定温度下,可逆反应X(g)+3Y(g)
2Z(g)达到平衡的标志是
①Z生成的速率与Z分解的速率相等 ②单位时间生成a mol X,同时生成3a mol Y
③X、Y、Z的浓度不再变化 ④X、Y、Z的分子数比为1:3:2
⑤X、Y、Z的浓度相等 ⑥X、Y、Z的质量不再发生变化
A.①③⑥ B.①②③ C.①②⑤⑥ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
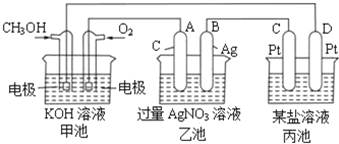
如图所示,甲池的总反应式为:
,下列关于该电池工作时的说法正确的是
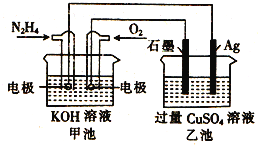
A.该装置工作时,Ag电极上有气体生成
B.甲池中负极反应为
C.甲池和乙池中的溶液的pH均减小
D.当甲池中消耗
时,乙池中理论上最多产生
固体
难度: 中等查看答案及解析
-
常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH‑)
B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3)
C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH‑) = c(H+)
D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH)
难度: 简单查看答案及解析
-
以下有关元素性质的说法不正确的是
A. 具有下列电子排布式的原子中:①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,④1s22s22p63s23p4,原子半径最大的是①
B. 具有下列价电子排布式的原子中:①3s23p1,②3s23p2,③3s23p3,④3s23p4,第一电离能最大的是③
C. ①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl,元素的电负性随原子序数增大而递增的是④
D. 某元素气态基态离子的逐级电离能分别为738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯气反应时可能生成的阳离子是X3+
难度: 中等查看答案及解析
-
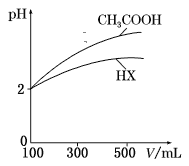
室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH= -lg c(OH-)。下列说法正确的是( )
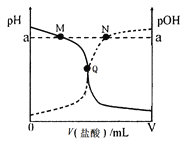
A.M点所示溶液中:c(NH4+)+c(NH3·H2O)= c(Cl-)
B.N点所示溶液中:c(NH4+)>c(Cl-)
C.Q点所示消耗盐酸的体积等于氨水的体积
D.M点和N点所示溶液中水的电离程度相同
难度: 困难查看答案及解析
-
常温下,向1L1nol/L某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的
与pH变化的关系如图所示.下列叙述正确的是

A.M线表示
随pH的变化 B.BR溶液呈碱性
C.若温度升高,两条线均向上平移 D.常温下,0.1mol·L-1NaR溶液的pH=10
难度: 困难查看答案及解析
-
一定条件下存在反应:2SO2(g)+O2(g)
2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )

A.容器I、III中平衡常数相同
B.容器II、III中正反应速率相同
C.
的体积分数:
D.容器I和容器II中
的体积分数相同
难度: 困难查看答案及解析