-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 0.1mol•L﹣1FeCl3溶液:Na+、ClO﹣、SO42﹣、SCN﹣
B. 0.1mol•L﹣1NaOH溶液:K+、NO3﹣、Br﹣、SiO32﹣
C. 0.1mol•L﹣1Ba(OH)2溶液:Al3+、NH4+、NO3﹣、HCO3﹣
D. 0.1mol•L﹣1KI溶液:Mg2+、NH4+、MnO4﹣、Cl﹣
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A. FeCl3易发生水解,可用于蚀刻铜制的印制线路板
B. 漂白粉具有氧化性,可用于脱除烟气中SO2和NO
C. CaCO3高温下能分解,可用于修复被酸雨侵蚀的土壤
D. 活性炭具有还原性,可用于除去水体中Pb2+等重金属
难度: 中等查看答案及解析
-
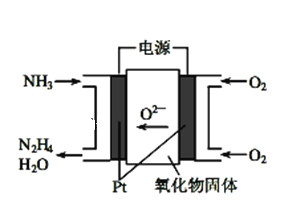
锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)42-。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-) 逐渐减小
C.放电时,负极反应为:Zn+4OH–-2e–= Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
化学与生活、环境密切相关,下列说法错误的是( )
A.生活中钢铁制品生锈主要是由于发生吸氧腐蚀所致
B.将氨气催化氧化生成NO,属于氮的固定
C.维纶被称为“人造棉花”,是因为其分子链上含有羟基的缘故
D.氢氧化铝是医用的胃酸中和剂的一种
难度: 中等查看答案及解析
-
化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是( )
A.石英玻璃、分子筛的主要成分是硅酸盐
B.分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液和胶体之间
C.海水淡化可以解决淡水危机,向海水中加入明矾可使海水淡化
D.农业废弃物、城市与工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1L0.5mol/LNaHCO3溶液中含有的HCO3-数目小于0.5NA
B.标准状况下,
与
在光照条件下反应生成HCl分子数为
C.容器中2molNO与1molO2充分反应,产物的分子数为2NA
D.电解精炼铜时阳极减轻32 g,电路中转移电子数目一定为NA
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.用氨水吸收足量的SO2气体:2OH-+SO2=SO32-+H2O
B.NaClO将污水中的NH3氧化成N2: 3ClO-+2NH3=N2↑+3C1-+3H2O
C.酸性条件下,用H2O2将Fe2+转化为Fe3+:H2O2+Fe2++2H+=Fe3++2H2O
D.NH4Al(SO4)2溶液与过量NaOH溶液反应:A13++4OH-=AlO2-+2H2O
难度: 简单查看答案及解析
-
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l);ΔH1
2 H2(g)+ O2(g)= 2H2O(g);ΔH2
C(s)+ O2(g)=CO2(g);ΔH3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的ΔH为
A.12ΔH3+5ΔH2-2ΔH1 B.2ΔH1-5ΔH2-12ΔH3
C.12ΔH3-5ΔH2-2ΔH1 D.ΔH1-5ΔH2-12ΔH3
难度: 中等查看答案及解析
-
下列实验操作、现象及所得出的结论或解释均正确的是
选项
实验操作
现象
结论或解释
A
向盐酸中滴加Na2SO3溶液
产生使品红溶液褪色的气体
非金属性:Cl>S
B
向废FeCl3蚀刻液X中加入少量的铁粉,振荡
未出现红色固体
X中一定不含Cu2+
C
向酸性KMnO4溶液中滴加乙醇
溶液褪色
乙醇具有还原性
D
用3 mL稀硫酸与纯锌粒反应,再加入几滴 Cu(NO3)2浓溶液
迅速产生无色气体
形成Zn-Cu原电池加快了制取H2的速率
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关实验的描述正确的是:
A.要量取15.80mL溴水,须使用棕色的碱式滴定管
B.用pH试纸检测气体的酸碱性时,需要预先润湿
C.溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出碘
D.中和热测定时环形玻璃搅拌棒要不断顺时针搅拌,主要目的是为了充分反应
难度: 中等查看答案及解析
-
主族元素X、Y、Z、W、R、T的原子序数依次增大,且均不大于20。其中X-的电子层结构与氦相同,R和Y同族,Y元素的某种单质是一种自来水消毒剂;Z3+和Y2-具有相同的电子层结构;T、W、Y三种元素组成盐T2WY3的溶液通入过量CO2后产生白色沉淀。下列说法不正确的是( )
A. 原子半径:T>R>W>Z
B. T和R形成化合物的水溶液呈碱性
C. 化合物TX具有很强的还原性,可与水反应
D. T、R、Z三种元素的最高价氧化物对应的水化物两两能发生反应
难度: 中等查看答案及解析
-
现有原子序数依次增大的短周期元素W、X、Y、Z,其中W和X位于同主族,且原子序数相差2,Y是形成化合物最多的元素,Z的单质可以通过电解饱和食盐水获得,下列说法正确的是( )
A. 由W和Y组成的化合物中只可能含有极性共价键
B. 简单离子半径:r(W—)>r(X+)
C. 室温下,同浓度的氧化物对应水化物水溶液的pH:Z<Y
D. Y、Z、W三元素形成的化合物有可能是电解质
难度: 中等查看答案及解析
-
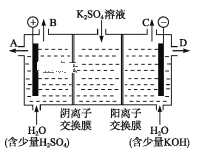
中国是一个严重缺水的国家,污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的是
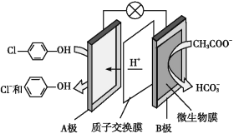
A. 电流方向从A极沿导线经小灯泡流向B极
B. B极为电池的阳极,电极反应式为CH3COO—— 8e− + 4H2O ═ 2HCO3—+9H+
C. 当外电路中有0.2 mol e−转移时,通过质子交换膜的H+的个数为0.2NA
D. A极的电极反应式为
+ H++2e− ═ Cl−+
难度: 中等查看答案及解析
-
一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g)
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min)
0
t1
t2
t3
NH3物质的量(mol)
0
0.2
0.3
0.3
A.0~t1min,v(NH3)=0.2/t1mol·L-1·min-1
B.t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C.N2(g)+3H2(g)
2NH3(g)的活化能小于2NH3(g)
N2(g)+3H2(g)的活化能
D.升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
难度: 中等查看答案及解析
-
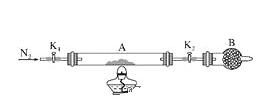
一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是
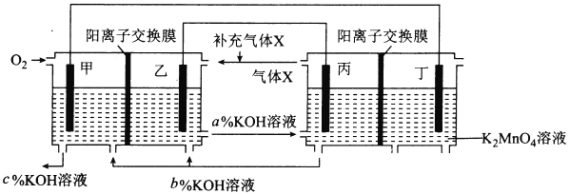
A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
难度: 困难查看答案及解析