-
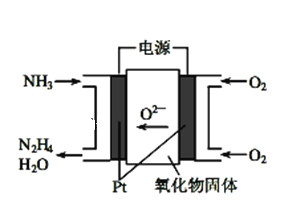
(1)工业上利用N2和H2合成NH3,NH3又可以进一步制备联氨(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,其离子反应方程式为______________________,有学者探究用电解法制备的效率,装置如图,试写出其阳极电极反应_________________________;
(2)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇(CH3CH2OH)的一种反应原理为:2CO(g)+4H2(g)  CH3CH2OH(g)+H2O(g) △H=-akJ/mol,己知:CO(g)+H2O(g)
CH3CH2OH(g)+H2O(g) △H=-akJ/mol,己知:CO(g)+H2O(g)  CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇及水蒸气,并放出热量,写出该反应的热化学反应方程式: _______________________________。
CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇及水蒸气,并放出热量,写出该反应的热化学反应方程式: _______________________________。
(3)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
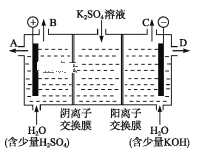
①该电解槽的阳极反应为_______________。 此时通过阴离子交换膜的离子数_____(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)_______导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因______________________。
-
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。
(1)火箭常用N2H4作燃料,N2O4作氧化剂。已知:
N2(g) + 2O2(g) =2NO2(g) △H = +67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)  1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
。
 (2)联氨——空气燃料电池是一种碱性燃料电池,电
(2)联氨——空气燃料电池是一种碱性燃料电池,电
解质溶液是20%~30%的氢氧化钾溶液。该电
池放电时,正极的电极反应式为 。
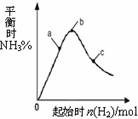
(3)在300℃时,改变起始反应物中氢气的物质的量
对反应N2(g) + 3H2(g)  2NH3(g) △H<0
2NH3(g) △H<0
的影响如右图所示。
①请在图中画出400℃时对应的图像。
②在a、b、c三点中,H2 的转化率最高的是 (填字母)。
-
(14分)
“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g) △H = +67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)  1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
_______________________________________________________________________。
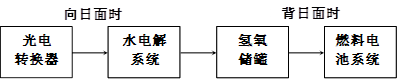
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
燃料电池放电时的负极反应为:___________________________________。
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为______________mol。
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH——4e— = O2↑+2H2O,则阴极反应为:____________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行?_______,理由是:___________________________________。
-
氮元素可以形成多种氢化物,如NH3、N2H4等。
(1)工业上,可用次氯酸钠与氨反应制备N2H4(肼),副产物对环境友好,写出反应的化学方程式________。
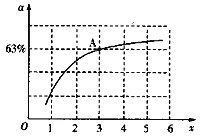
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如图所示:
CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如图所示:

①该反应的ΔH_____0(填“>”或“<”)。
②已知原料气中的氨碳比[ ]为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如图所示。a随着x的增大而增大的原因是______。图中A点处,NH3的平衡转化率为__________。
]为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如图所示。a随着x的增大而增大的原因是______。图中A点处,NH3的平衡转化率为__________。
(3)①在氨水加水稀释的过程中,NH3·H2O的电离程度增大, 的值_______。(填“增大”、“减小”或“不变”,)
的值_______。(填“增大”、“减小”或“不变”,)
②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是_____(用离子方程式表示),该反应的平衡常数为______(用含a的数学表达式表示)。
-
阿伏加德罗常数的值为NA,实验室制备联氨(N2H4)的化学方程式为:2NH3 +NaClO=N2H4 +NaCl+ H2O。下列说法正确的是
A. 0. lmolN2H4中所含质子数为1. 8NA
B. 0. 1mol·L-1的NaClO溶液中,ClO-的数量为0.1NA
C. 消耗4.48LNH3时,转移电子数为0.2NA
D. 1.6g N2H4中存在共价键总数为0.2NA
-
(16分)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mo
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为________。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 
2NH3(g)反应的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
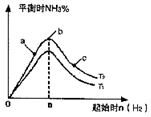
①图像中T2和T1的关系是:T2________T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是________(填字母)。
③在起始体系中加入N2的物质的量为________mol时,反应后氨的百分含量最大。若容器容积为H,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=________。
(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:
2N2O3 4NO2(g)+O2 △H>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2 △H>0下表为反应在T1温度下的部分实验数据
| Vs | 0 | 500 | 1000 |
| c(N2O3)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为________.
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O3,装置如图所示,其中Y为CO2。
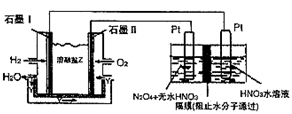
写出石墨I电极上发生反应的电极反应式________。
在电解池中生成N2O3的电极反应式为________。
-
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续地生产。请回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
则NH3催化氧化生成NO和H2O(g)的热化学反应方程式可表示为: 。
(2)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如右图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如右图所示的规律(图中T表示温度,n表示物质的量):
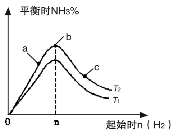
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是 。
②在起始时体系中加入N2的物质的量为1mol。若容器容积
为2L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。
③图像中T1和T2的关系是:T1 T2。(填“>”“<”“=”“无法确定”)
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如下图):
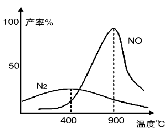
4NH3+5O2 4NO+6H2O ;
4NO+6H2O ;
4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因 。
(4)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g) △H>0,下表为反应在T1温度下的部分实验数据:
4NO2(g)+O2(g) △H>0,下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的生成速率可表示为____________________。
②下列情况能说明该反应已达平衡状态的是 。
A.单位时间内生成2mol NO2的同时消耗了lmol N2O5 B.混合气体的颜色不再发生变化
C.混合气体的密度保持不变 D.在绝热恒容的容器中,反应的平衡常数不再变化
-
(1)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
②N2(g)+3H2(g)  2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
③2H2(g)+O2(g) = 2H2O(g) △H=-483.6 kJ/mol
氨催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 。
(2)研究在其他条件不变时,改变起始物氢气的物质的量对N2(g)+3H2(g)  2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):
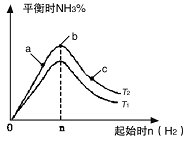
①图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)。
②a、b、c三点中,N2转化率最高的是 (填字母)。
③若容器容积为1L,T2℃在起始体系中加入1 mol N2 ,n(H2)=3mol,经过5 min反应达到平衡时H2的转化率为60%,则v(NH3)= 。保持容器体积不变,若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q___110.88 kJ(填“>”、“<”或“=”)。
-
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 .
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2.
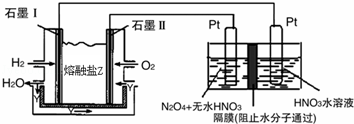
写出石墨I电极上发生反应的电极反应式 .
在电解池中生成N2O5的电极反应式为 .
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为 L.
-
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为______;
(2)某科研小组研究在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)⇌2NH3(g)反应的影响,实验结果如图2所示:(图中T表示温度,n表示物质的量)
①图象中T1和T2的关系是:T1______T2(填“>”、“<”、“=”或“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______(填字母标号),
③在起始体系中加入N2的物质的量为______mol时,反应后氨的百分含量最大.若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=______;
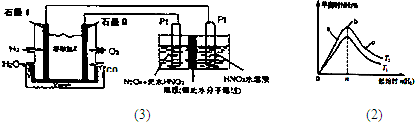
(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注.
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:2N2O3⇌4NO2(g)+O2△H>0下表为反应在某温度下的部分实验数据则50s内NO2的平均生成速率为______
| V/s | | 50 | 100 |
| c(N2O3)/mol•L-1 | 5.00 | 3.52 | 2.48 |
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O3,装置如图1所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式______

CH3CH2OH(g)+H2O(g) △H=-akJ/mol,己知:CO(g)+H2O(g)
CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇及水蒸气,并放出热量,写出该反应的热化学反应方程式: _______________________________。

 (2)联氨——空气燃料电池是一种碱性燃料电池,电
(2)联氨——空气燃料电池是一种碱性燃料电池,电








