-
下列环境问题与二氧化碳的排放有关的是( )
A.酸雨 B.臭氧空洞 C.温室效应 D.光化学烟雾
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.碳酸氢钠的热稳定性比碳酸钠的强
B.等质量的碳酸钠、碳酸氢钠分别与足量的盐酸反应,前者产生的二氧化碳少
C.足量的碳酸钠、碳酸氢钠分别与等物质的量的盐酸反应,两者产生的二氧化碳一样多
D.等物质的量的碳酸钠、碳酸氢钠分别与足量的盐酸反应,前者消耗的盐酸少
难度: 中等查看答案及解析
-
对下列事实的解释正确的是
A.蘸有浓硫酸和蘸有浓氨水的玻璃棒靠近没有白烟,说明硫酸与氨气不反应
B.向50mL18mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol
C.医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡难溶于酸,且不易被X射线穿透
D.常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓硫酸不反应
难度: 中等查看答案及解析
-
将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO4=Fe2O3+SO2↑+SO3↑。如将生成的混合气体通过足量Ba(NO3)2溶液,应发生的现象有( )
A.产生的沉淀只有BaSO4和BaSO3 B.产生的沉淀只有BaSO4
C.一定有SO2逸出 D.一定有SO3逸出
难度: 中等查看答案及解析
-
已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )
A.该反应中的H2SO4只体现酸性,不体现氧化性
B.1molKClO3参加反应时有5mol电子转移
C.发生氧化反应与还原反应的氯元素的质量比为5:1
D.生成标准状况下22.4LCl2,则有
molKClO3被还原
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,3.36L氧气与3.2g硫反应,生成SO2分子数为0.1NA
B.1L0.1mol·L-1氨水中NH3·H2O分子数为0.1NA
C.标准状况下,1.12L氯气发生反应转移的电子数一定为0.1NA
D.46gNO2和N2O4混合气体中氧原子总数为3NA
难度: 中等查看答案及解析
-
下列反应的离子方程式中,正确的是( )
A.向苏打溶液中加入足量醋酸:CO32-+2H+=CO2↑+ H2O
B.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
C.向含amol溴化亚铁的溶液中通入1.2amol氯气充分反应:10Fe2++14Br-+12Cl2=10Fe3++7Br2-+24Cl-
D.氢氧化铁与氢碘酸的反应:Fe(OH)3+3H+=Fe3++3H2O
难度: 中等查看答案及解析
-
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+。取该溶液100mL,加入过量NaOH溶液并加热,得到0.02mol气体,同时产生红褐色沉淀,将过滤洗涤后的沉淀灼烧得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。下列说法正确的是
A.该溶液中最多存在4种离子
B.该溶液中不能确定是否存在CO32-
C.该溶液中一定存在Cl-、且c(Cl-)≥0.4mol∙L-1
D.该溶液可由KCl、(NH4)2SO4和FeCl3配制而成
难度: 中等查看答案及解析
-
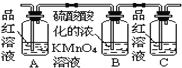
下列图示中能较长时间看到Fe(OH)2白色沉淀的有( )
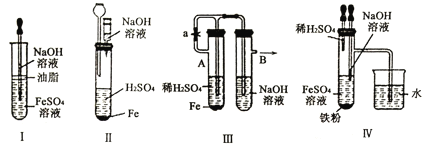
A.Ⅰ、Ⅱ、Ⅲ B.Ⅰ、Ⅱ、Ⅳ C.Ⅰ、Ⅲ、Ⅳ D.Ⅰ、Ⅱ、Ⅲ、Ⅳ
难度: 中等查看答案及解析
-
对于某些物质或离子的检验及结论正确的是( )
A.某气体能使湿润淀粉碘化钾试纸变蓝,则该气体一定是氯气
B.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,则原溶液中一定含有Fe2+
C.向某溶液中加入足量盐酸,产生的无色无味气体能使澄清石灰水变浑浊,该溶液中一定含有CO32-
D.向某溶液中滴加NaOH溶液后,加热,用湿润蓝色石蕊试纸检验发现变红,该溶液中一定含有NH4+
难度: 中等查看答案及解析
-
在含有Fe2(SO4)3和CuSO4的溶液中加入铁粉,下列说法中不正确的是( )
A.若铁粉有剩余,则不溶物中一定有铜
B.若铁粉有剩余,则溶液中的金属阳离子只有Fe2+
C.若铁粉无剩余,且溶液中有Cu2+,则溶液中一定无Fe3+
D.若铁粉无剩余,且溶液中无Cu2+,则溶液中一定有Fe2+,一定无Fe3+
难度: 中等查看答案及解析
-
下列各组离子中,能在溶液中大量共存的是( )
A.Na+、Mg2+、Br-、SO42- B.K+、Ca2+、HCO3-、OH-
C.Fe2+、H+、SO42-、NO3- D.Na+、Cu2+、Cl-、S2-
难度: 中等查看答案及解析
-
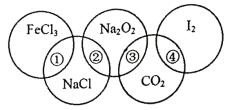
在海水综合利用中,下列叙述不正确的是( )
A.海水经过蒸发结晶得到粗盐
B.海水中提取溴单质可以用氯气将海水中的Br-氧化
C.海水提镁的工艺中用贝壳为原料生产石灰乳
D.海水中提取镁单质的方法是海水
Mg(OH)2
Mg
难度: 中等查看答案及解析
-
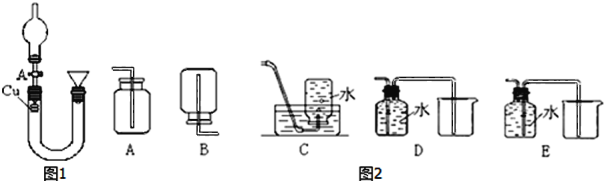
下面是实验室制取氨气的装置和选用的试剂,其中正确的是( )
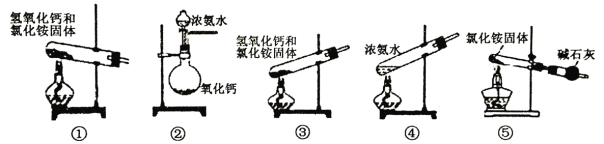
A.①②④ B.只有③ C.①③④ D.①②
难度: 中等查看答案及解析
-
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL (换算为标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2 ︰1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54沉淀时,加入NaOH溶液的体积是600mL
难度: 中等查看答案及解析