-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.28gN2与6gH2充分反应,生成NH3分子的数目为2NA
B.6.4gCu与过量S充分反应,转移电子的数目为0.2NA
C.标准状况下,2.24LC2H5OH中含有分子的数目为0.1NA
D.25℃时,1LpH=1的H2SO4溶液中含有H+的数目为0.1NA
难度: 中等查看答案及解析
-
脂环烃分子中两个或两个以上碳环共有两个以上碳原子的烃称为桥环烃,二环[4.1.0]庚烷(
)是一种典型的桥环烃,下列关于二环[4.1.0]庚烷的说法错误的是( )
A.与环庚烯互为同分异构体
B.所有的碳原子均在同一平面上
C.一氯代物有4种(不考虑立体异构)
D.二环[4.1.0]庚烷易溶于CCl4,难溶于水
难度: 中等查看答案及解析
-
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由C元素形成的单质,已知甲+乙=丁+己,甲+丙=戊+己,0.1mol·L-1丁溶液的pH为13(25℃)。下列说法正确的是
A. 原子半径:D>C >B>A
B. B元素只能形成一种二元含氧酸,且B元素的含氧酸对应的酸酐一定是氧化物
C. 1mol甲与足量乙反应转移电子的数目为NA
D. 1.0L 0.1mol·L-1戊溶液中阴离子总的物质的量小于0.1mol
难度: 中等查看答案及解析
-
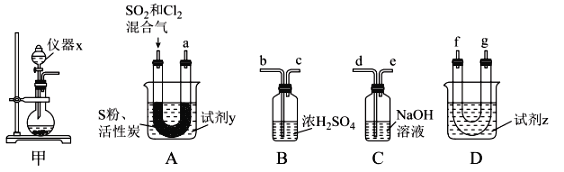
利用下列实验装置进行实验,能达到实验目的的是( )



A.制取CO2
B.干燥NH3
C.收集NO
D.收集CH3COOC2H5
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
中科院科学家设计出一套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )
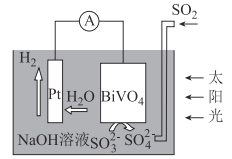
A. 该电化学装置中,Pt电极作正极
B. BiVO4电极上的反应式为SO32--2e-+2OH=SO42-+H2O
C. 电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D. Pt电极的电势高于BiVO4电极的电势
难度: 中等查看答案及解析
-
常温下,用0.10mol·L-1盐酸分别滴定20.00mL浓度均为0.1mol· L-1CH3COONa溶液和NaCN溶液,所得滴定曲线如图所示。下列说法正确的是

A.①所示溶液中:c(Cl-)>c(HCN)>c(CN-)>c(OH-)
B.②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.阳离子物质的量浓度之和:②与③所示溶液中相等
D.④所示溶液中:c(CH3COOH)+ c(H+)-c(OH-)=0.05 mol·L-1
难度: 困难查看答案及解析


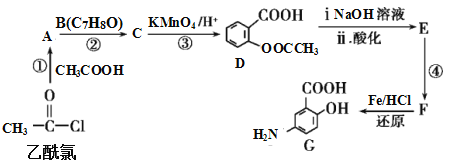
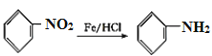
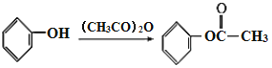 ,
,
 Y
Y