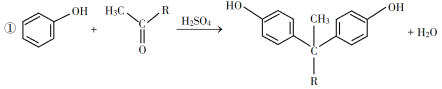
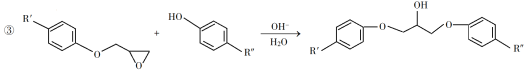
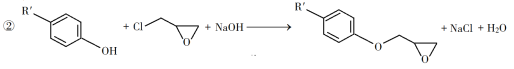-
化学与工农业生产、日常生活、材料等有密切的联系,下列说法正确的是( )
A.华为公司自主研发的“麒麟970芯片”需要以高纯度的二氧化硅为原料
B.笔、墨、纸、砚为传统的文房四宝,上述物质中的(毛)笔与(宣)纸均含有机物
C.《梦溪笔谈》中“取精铁锻之百余火,…则纯钢也,虽百炼,不耗矣。”百炼钢熔点比纯铁高
D.高纤维食物是富含膳食纤维的食物,在人体内都可通过水解反应提供能量
难度: 简单查看答案及解析
-
下列有关叙述不正确的是( )
A.为方便运输可用钢瓶储存液氯和浓硫酸
B.能源是人类生活和社会发展的基础,地球上最基本的能源是太阳能
C.钛合金主要用于制作飞机发动机部件,工业上可用钠与四氯化钛溶液反应制取
D.化石燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
难度: 中等查看答案及解析
-
关于一些重要的化学概念有下列说法,其中正确的是( )
①Fe(OH)3胶体和CuSO4溶液都是混合物 ②BaSO4是一种难溶于水的强电解质 ③冰醋酸、纯碱、小苏打分别属于酸、碱、盐 ④煤的干馏、煤的气化和液化都属于化学变化 ⑤置换反应都属于离子反应
A.①②⑤ B.①②④ C.②③④ D.③④⑤
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,33.6LHF中含有氟原子的数目为1.5NA
B.2.8gCO与C2H4的混合气体中所含分子数为0.1NA
C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.含1molFeCl3的氯化铁溶液完全水解生成Fe(OH)3胶体,其中胶粒数为NA
难度: 中等查看答案及解析
-
下列除杂方案不正确的是( )
被提纯的物质[括号内物质是杂质]
除杂试剂
除杂方法
A
CO(g) [CO2(g)]
NaOH溶液、 浓H2SO4
洗气
B
NH4Cl(aq) [Fe3+(aq)]
NaOH溶液
过滤
C
Cl2(g) [HCl(g)]
饱和食盐水、浓H2SO4
洗气
D
Na2CO3(s) [NaHCO3(s)]
—
加热
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关物质的性质与用途不具有对应关系的是( )
A.浓硫酸具有脱水性,可用作干燥剂
B.SO2具有漂白性,可用于漂白纸浆
C.液氨汽化时吸收大量的热,可用作制冷剂
D.SiO2与碱反应,不可用石英坩埚来加热熔化烧碱、纯碱等固体
难度: 中等查看答案及解析
-
下列各组离子在溶液中一定能大量共存的是
A.澄清透明的溶液中:MnO4-、SO42-、K+、H+
B.含有大量的AlO2-的溶液:NH4+、Na+、HCO3-、SO42-
C.pH=11的溶液中:ClO-、Na+、SO42-、I-
D.水电离产生的c(H+)=1×10-14 mol·L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确,且两者具有因果关系的是( )
选项
实验
现象
结论
A
将盐酸滴入0.5 mol/LFe(NO3)2溶液中
溶液变黄色,有无色气体逸出,后又变成红棕色
Fe2+被HNO3氧化
B
向淀粉溶液中加入稀硫酸加热几分钟冷却后再加入新制的Cu(OH)2悬浊液,加热
得到蓝色溶液
淀粉没有水解
C
向FeCl3和BaCl2混合溶液中通入足量的SO2
溶液变为浅绿色,且有白色沉淀生成
沉淀为BaSO3,BaSO4的混合物
D
用湿润的蓝色石蕊试纸检验某气体
试纸变红
该气体是氨气
A.A B.B. C.C D.D
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.12g NaHSO4晶体中阳离子和阴离子的总数为0.3NA
B.密闭容器中2 mol NO与1mol O2充分反应,产物的分子数目为2NA
C.在一定条件下,6.4g铜与过量的硫反应,转移的电子数目为0.2NA
D.10g质量分数为46%的乙醇溶液中O-H键数目为0.7NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH−+NH4++HCO3−=BaCO3↓+NH3·H2O+H2O
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C.用铁电极电解氯化钠溶液:2Cl−+2H2O
2OH−+H2↑+Cl2↑
D.将SO2通入Ca(ClO)2溶液中:Ca2++2ClO−+SO2+H2O=CaSO3↓+2HClO
难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A.用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率
B.pH试纸使用时不需要润湿,红色石蕊试纸检测氨气时也不需要润湿
C.做过硫升华实验的试管用酒精洗涤
D.蒸馏操作时,装置中的温度计的水银球应位于蒸馏烧瓶中的液体中部
难度: 中等查看答案及解析
-
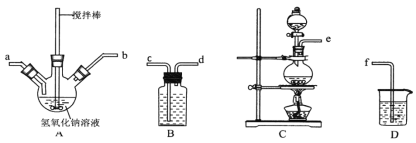
下列操作正确且能达到实验目的是( )
A.制取氢氧化亚铁并观察其颜色
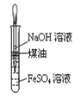
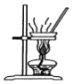
B.制备无水氯化镁
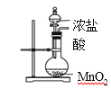
C.装置可用于实验室制Cl2
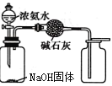
D.制取收集干燥纯净NH3
难度: 中等查看答案及解析
-
在室温下,下列各组离子一定能大量共存的是( )
A.滴入石蕊试液显红色的溶液:K+、Mg2+、AlO2−、SO32−
B.1.0mol·L−1的KNO3溶液:H+、Fe2+、Cl−、SO42−
C.在
=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3−
D.通入足量CO2的溶液:Ca2+、Cl−、K+、Na+
难度: 中等查看答案及解析
-
下列物质间转化符合工业生产实际的是( )
A.N2
NO
NO2
HNO3
B.海水
Mg(OH)2
MgCl2(aq)
Mg
C.S
SO3
H2SO4
D.NaCl(饱和溶液)
Cl2
漂白粉
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.食醋除水垢:
B.稀硝酸中加入少量亚硫酸钠:
C.处理工业废水时Cr(Ⅵ)的转化:
D.用酸性KMnO4测定草酸溶液浓度:
难度: 中等查看答案及解析
-
丰富多彩的颜色变化增添了化学的魅力。下列颜色变化过程中气体被氧化的是( )
A.水蒸气使淡黄色过氧化钠变白色
B.CuSO4蓝色溶液吸收H2S后有黑色沉淀
C.SO2能使溴水褪色
D.C12使湿润的淀粉碘化钾试纸变蓝
难度: 中等查看答案及解析
-
把8.0g铁粉投入40mL某HNO3溶液中,充分反应后剩余固体2.4g,产生NO2和NO的混合气体0.12mol。若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度( )
A.6.0mol·L-1 B.7.0mol·L -1 C.8.0mol·L -1 D.9.0mol·L -1
难度: 中等查看答案及解析
-
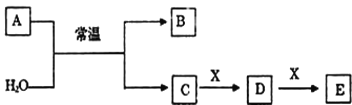
如图所示过程除去 AlCl3溶液中含有的 Mg2+、K+ 杂质离子并尽可能减小 AlCl3 的损失。下列说法正确的是

A.NaOH 溶液可以用Ba(OH)2溶液来代替 B.溶液a中含有 Al3+、K+、Cl-、Na+、OH-
C.溶液 b 中只含有 NaCl D.向溶液a和沉淀a中滴加盐酸都要过量
难度: 中等查看答案及解析
-
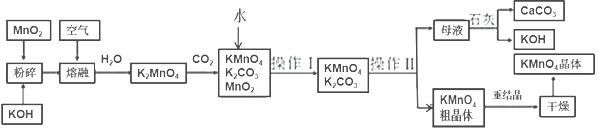
如图是工业利用菱镁矿(主要含MgCO3,还含有Al2O3、FeCO3杂质)制取氯化镁的工艺流程。
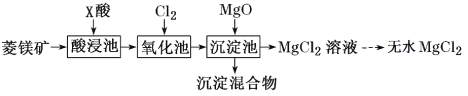
下列说法不正确的是( )
A.酸浸池中加入的X酸是硝酸
B.氧化池中通入氯气的目的是将Fe2+氧化为Fe3+
C.沉淀混合物为Fe(OH)3和Al(OH)3
D.在工业上常利用电解熔融氯化镁的方法制取金属镁
难度: 中等查看答案及解析
-
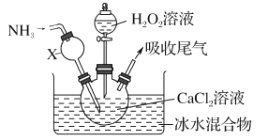
氮化镁常用于制备其它超硬、高导热、耐高温的氮化物,实验室用以下装置制取氮化镁。已知:Mg+2NH3
Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。下列说法不正确的是
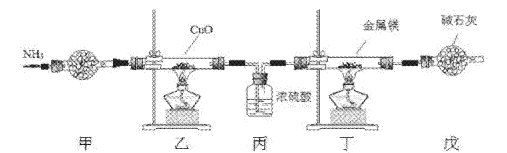
A. 实验开始时应先点燃乙处酒精灯,再点燃丁处酒精灯
B. 装置乙的目的是制备N2
C. 装置丙与装置戊可以对调
D. 取装置丁所得固体少许,滴入少量蒸馏水,可检验是否有Mg3N2
难度: 中等查看答案及解析
-
下列有关图像的说法正确的是

A. 图甲表示:向某明矾溶液中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与滴加NaOH溶液体积的关系
B. 图乙表示:向含等物质的量的NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸至过量,生成气体的体积与滴加HCl溶液体积的关系
C. 图丙表示:在稀硝酸溶液中逐渐加入铁粉至过量,溶液中Fe3+物质的量与逐渐加入铁粉物质的量的变化关系
D. 除去混在硝酸钾中少量的氯化钠可用“蒸发浓缩、趁热过滤”的方法
难度: 困难查看答案及解析
-
工业上处理黄铜矿(主要成分是CuFeS2)的主要反应是2CuFeS2 + 4O2= Cu2S + 3SO2 + 2FeO。关于该反应的下列说法中,不正确的是( )
A.CuFeS2既是氧化剂又是还原剂
B.还原产物有Cu2S、SO2、FeO
C.Fe元素的化合价没有变化
D.每反应1 molCuFeS2,转移电子8 mol
难度: 中等查看答案及解析