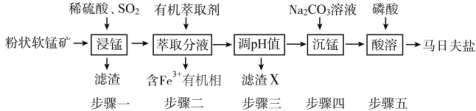
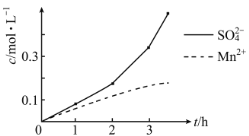
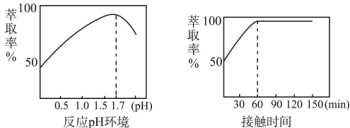
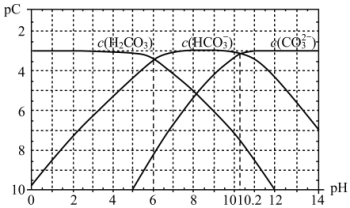
-
《天工开物》中关于化学物质的记载很多,如石灰石“经火焚炼为用”、“世间丝麻皆具素质”。下列相关分析不正确的是( )
A.石灰石的主要成分是CaCO3,属于正盐
B.“经火焚炼”时石灰石发生的反应属于氧化还原反应
C.丝和麻主要成分均属于有机高分子类化合物
D.丝和庥在一定条件下均能水解生成小分子物质
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.2 molNO2与水充分反应,转移电子数为NA
B.含0.1molH3PO4的水溶液中PO43-的数目为0.1NA
C.0.5molNa2O2中O-的数目为NA
D.标况下,42g丙烯和丁烯混合物含C数目为3NA
难度: 简单查看答案及解析
-
为达到下列实验目的,对应的实验方法以及相关解释均正确的是( )
选项
实验目的
实验方法
相关解释
A
测量氯水的pH

pH试纸遇酸变红
B
探究正戊烷(C5H12) 催化裂解

C5H12裂解为分子较小的烷烃和烯烃
C
实验温度对平衡移动的影响

2NO2(g)
N2O4(g)为放热反应,升温平衡逆向移动
D
用AlCl3溶液制备AlCl3晶体

AlCl3沸点高于溶剂水
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
有机物三苯基甲苯的结构简式为
 ,对该有机物分子的描述正确的是( )
,对该有机物分子的描述正确的是( )A.1~5号碳均在一条直线上
B.在特定条件下能与H2发生加成反应
C.其一氯代物最多有4种
D.其官能团的名称为碳碳双键
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W在大气中有两种同素异形体且均能支持燃烧,X的原子半径是所有短周期主族元素中最大的,非金属元素Y的原子序数是Z的最外层电子数的2倍。下列叙述不正确的是( )
A.Y、Z的氢化物稳定性Y>Z
B.Y单质的熔点高于X单质
C.X、W、Z能形成具有强氧化性的XZW
D.
中W和Y都满足8电子稳定结构
难度: 简单查看答案及解析
-
常温下,Mn+(指Cu2+或Ag+)的硫化物的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.直线MN代表CuS的沉淀溶解平衡
B.在N点Ksp(CuS)=Ksp(Ag2S)
C.P点:易析出CuS沉淀,不易析出Ag2S沉淀
D.M点和N点的c(S2-)之比为1×10-20
难度: 中等查看答案及解析
-
中国科学家研究出对环境污染小、便于铝回收的海水电池,其工作原理示意图如下:
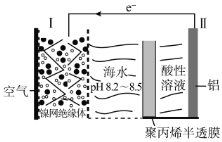
下列说法正确的是( )
A.电极Ⅰ为阴极,其反应为:O2+4H++4e-=2H2O
B.聚丙烯半透膜允许阳离子从右往左通过
C.如果电极II为活性镁铝合金,则负极区会逸出大量气体
D.当负极质量减少5.4g时,正极消耗3.36L气体
难度: 简单查看答案及解析