-
我国具有光辉灿烂的古代科技,早在商代就已经铸造出司母戊大方鼎。回答下列问题:
(1)Cu在元素周期表中的位置___,Cu2+的价电子排布式为__。
(2)已知基态铜的部分电离能如表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 |
| Cu | 746 | 1958 | 2058 |
由表格数据知,I2(Cu)远远大于I1(Cu),其原因是__。
(3)Cu2+能与吡咯( )的阴离子(
)的阴离子( )形成双吡咯铜。
)形成双吡咯铜。
① 中C和N原子的杂化均为__,1mol
中C和N原子的杂化均为__,1mol 含有__molσ键;
含有__molσ键;
②双吡咯铜Cu( )2的配位原子为__;
)2的配位原子为__; 噻吩的沸点为84℃,吡咯(
噻吩的沸点为84℃,吡咯( )的沸点在129~131℃之间,吡咯沸点较高,其原因是__。
)的沸点在129~131℃之间,吡咯沸点较高,其原因是__。
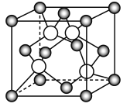
(4)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(白球代表M原子)。每个铜原子周围距离最近的铜原子数目__;该晶体的化学式为__。已知该晶体的密度为ρg·cm-3,晶体的摩尔质量为Mg/mol,阿伏伽德罗常数的值为NA,则该晶体中铜原子和M原子之间的最短距离为__pm(只写计算式)。
-
[化学——选修3:物质结构与性质]
黄铜专指铜锌合金,始于明代《明会典》,古代黄铜主要用于铸币和铸造雕塑。回答下列问题:
(1)Zn元素在周期表中的位置为_____________,基态Zn2+外围电子排布式为_____________。
(2)硝酸铜溶液可与乙二胺( )形成配位化合物[Cu(en)2](NO3)2(“en”表示乙二胺)。
)形成配位化合物[Cu(en)2](NO3)2(“en”表示乙二胺)。
①NO3-的空间构型为_____________。
②Cu2+与乙二胺分子之间存在的化学键类型为______________,在乙二胺分子中提供孤电子对的原子是_____________。
③在乙二胺分子中C的杂化轨道类型是_____________。
④乙二胺的沸点116℃,而相对分子质量比乙二胺大1的三甲胺( )的沸点只有2.87℃,其原因是___________________________________。
)的沸点只有2.87℃,其原因是___________________________________。
(3)铜的晶胞实物堆积模型如图所示,设铜的密度为ρg·cm-3。

①铜的晶体堆积方式为_____________。
②铜晶胞参数a=_____________cm(列出式子即可,设铜的摩尔质量为Mg·mol-1,阿伏伽德罗常数值为NA)。
-
中华民族有着灿烂的文明,用化学知识对以下几个事例的分析不合理的是( )
A. 商代后期铸造的青铜器属于铜合金制品,其熔点高于纯铜
B. 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土
C. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
D. 唐代后期出现的黑火药,它的燃烧属于氧化还原反应
-
铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)Cu2O中阳离子的基态核外电子排布式为__________________; Cu和Ni在元素周期表中的位置相邻, Ni在周期表中的位置是__________________。
(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 [Cu( NH3)4]SO4·H2O。
①乙醇分子中C 原子的轨道杂化类型为__________________,NH3与H+以配位键形成NH4+,则NH4+的空间构型为____________________。
②[Cu( NH3)4]SO4·H2O]中存在的化学键除了极性共价键外,还有____________________。
③NH3极易溶于水的原因主要有两个,一是_______________,二是_______________________。
(3)CuSO4溶液中加入过量KCN溶液能生成配离子[Cu(CN)4]2-,1mol CN-中含有的π键数目为__________。与CN-互为等电子体的离子有____________(写出一种即可)。
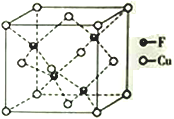
(4)Cu 与F形成的化合物的晶胞结构如图所示,若晶体密度为a g·cm-3,则Cu与F最近距离为____________pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。

-
铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)Cu2O中阳离子的基态核外电子排布式为__________________; Cu和Ni在元素周期表中的位置相邻, Ni在周期表中的位置是__________________。
(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 [Cu( NH3)4]SO4·H2O。
①乙醇分子中C 原子的轨道杂化类型为__________________,NH3与H+以配位键形成NH4+,则NH4+的空间构型为____________________。
②[Cu( NH3)4]SO4·H2O]中存在的化学键除了极性共价键外,还有____________________。
③NH3极易溶于水的原因主要有两个,一是_______________,二是_______________________。
(3)CuSO4溶液中加入过量KCN溶液能生成配离子[Cu(CN)4]2-,1mol CN-中含有的π键数目为__________。与CN-互为等电子体的离子有____________(写出一种即可)。
(4)Cu 与F形成的化合物的晶胞结构如图所示,若晶体密度为a g·cm-3,则Cu与F最近距离为____________pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。
-
陶瓷、青铜器、书画作品等都是中华文化的瑰宝,其中蕴藏丰富的化学知识。下列说法中错误的是( )
A.商代后期铸造出工艺精湛的青铜器司母戊鼎,其材质属于合金
B.宋•王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜
C.《茶经》中,唐代邢窑白瓷为上品,其烧制原料主要成分含有SiO2、A12O3、Fe2O3
D.书画作品用的纸张,其化学成分主要是纤维素
-
中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是( )
A. “千淘万漉虽辛苦,吹尽黄沙始到金”中“淘”“漉”相当于分离提纯操作中的“过滤”
B. 司母戊鼎属青铜制品,是我国古代科技光辉成就的代表之一
C. 瓷器(China)属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象
D. 侯德榜是我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱
-
第四周期过渡元素如铁、锰、铜、锌等在太阳能电池、磁性材料等科技方面有广泛的应用,回答下列问题:
(1)在现代化学中,常利用______上的特征谱线来鉴定元素,称为光谱分析。
(2)写出 Cu2+的外围电子排布式__________;比较铁与锰的第三电离能(I3):铁____锰(填“>”、 “=”或“<”),原因是________________。
(3)已知 [Zn(CN)4]2-与甲醛在水溶液中发生反应可生成一种新物质 HOCH2CN,试判断新物质中碳原子的杂化方式___________;1mol[Zn(CN)4]2-中的 σ 键数为__________。
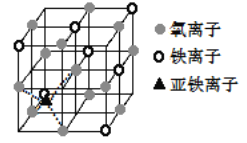
(4)如图是晶体 Fe3O4 的晶胞,该晶体是一种磁性材料, 能导电。
①晶胞中二价铁离子处于氧离子围成的______(填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为________。
③解释 Fe3O4 晶体能导电的原因_________________;若晶胞的体对角线长为 a nm,则 Fe3O4 晶体的密度为________g·cm-3(阿伏加德罗常数用 NA 表示)。
-
第四周期过渡元素如铁、锰、铜、锌等在太阳能电池、磁性材料等科技方面有广泛的应用,回答下列问题:
(1)在现代化学中,常利用______上的特征谱线来鉴定元素,称为光谱分析。
(2)写出 Cu2+的外围电子排布式__________;比较铁与锰的第三电离能(I3):铁____锰(填“>”、 “=”或“<”),原因是________________。
(3)已知 [Zn(CN)4]2-与甲醛在水溶液中发生反应可生成一种新物质 HOCH2CN,试判断新物质中碳原子的杂化方式___________;1mol[Zn(CN)4]2-中的 σ 键数为__________。
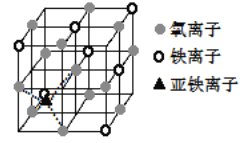
(4)如图是晶体 Fe3O4 的晶胞,该晶体是一种磁性材料, 能导电。
①晶胞中二价铁离子处于氧离子围成的______(填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为________。
③解释 Fe3O4 晶体能导电的原因_________________;若晶胞的体对角线长为 a nm,则 Fe3O4 晶体的密度为________g·cm-3(阿伏加德罗常数用 NA 表示)。
-
铁、铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)铁元素在周期表中的位置是_______,基态Cu2+的核外电子排布式是__________。元素铁与铜的第二电离能分别为:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu>IFe的原因是_________________。
(2)有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为:[Fe(H2NCONH2)6](NO3)3。
①尿素分子中C原子的杂化方式是__________。
②[Fe(H2NCONH2)6](NO3)3 中“H2NCONH2”与 Fe(Ⅲ)之间的作用力是_______。根据价层电子对互斥理论推测 NO3-的空间构型为____________。
(3)Fe3+可用SCN-检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_______, 原因是______________。
(4)FeCl3晶体易溶于水和乙醇,用酒精灯加热即可气化,由此可知 FeCl3的晶体类型为______;S和Fe形成的某化合物,其晶胞如图一所示, 则该物质的化学式为__________。
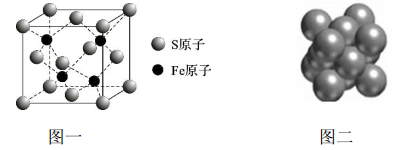
(5)Cu晶体的堆积方式如图二所示,晶体中Cu原子的配位数为_______;设Cu原子半径为a,晶体空间利用率为 _________(用含a 的式子表达,不化简)。
)的阴离子(
)形成双吡咯铜。
中C和N原子的杂化均为__,1mol
含有__molσ键;
)2的配位原子为__;
噻吩的沸点为84℃,吡咯(
)的沸点在129~131℃之间,吡咯沸点较高,其原因是__。






