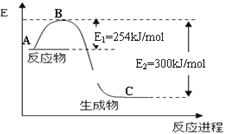
-
下列说法中错误的是
A. 凡是放热反应而且熵增加的反应,就更易自发进行
B. 对于同一物质在不同状态时的熵值是:气态>液态>固态
C. 平衡常数K值越大,则可逆反应进行越完全,反应物的转化率越大
D. 凡是能量达到活化能的分子发生的碰撞均为有效碰撞
难度: 中等查看答案及解析
-
人类与自然和谐发展需要节约能源和保护生态环境,你认为下列行为中有悖人类与自然和谐发展的是( )
A.研究页岩气(非常规天然气)、可燃冰开采技术,提高产量以满足工业生产的快速发展
B.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
C.在农村推广使用沼气
D.减少资源消耗、增加资源的重复使用和资源的循环再生
难度: 简单查看答案及解析
-
下列变化过程吸收热量的是( )
A.氮气液化 B.浓硫酸稀释 C.氧化钙与水反应 D.碘单质升华
难度: 简单查看答案及解析
-
CO(g)+ H2O(g)
CO2(g) + H2(g) △H<0,反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.降低温度 B.增加压强 C.用高效催化剂 D.增大CO 的浓度
难度: 简单查看答案及解析
-
在一定温度时,N2与H2反应过程中能量变化的曲线如图所示。下列叙述正确的是( )
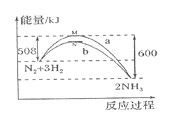
A.该反应的热化学方程式:N2+3H2
2NH3 ΔH=-92 kJ/mol
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应放出的热量增多
D.加入催化剂可增大正反应速率,降低逆反应速率
难度: 中等查看答案及解析
-
可逆反应2NO2
N2O4 △H<0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是( )
①减小压强;②缩小体积;③升高温度;④充入氦气
A.②④ B.①③ C.②③④ D.②③
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.光照新制的氯水时,溶液的pH逐渐减小
B.高温,使N2和H2转化为更多的NH3(△H<0)
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.增大压强,有利于SO2和O2反应生成SO3
难度: 简单查看答案及解析
-
在下列说法中正确的是( )
A.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热
B.1mol H2SO4与lmol Ba(OH)2完全反应时放出的热叫做中和热
C.已知C(s) +
O2(g) = CO(g) △H=-110.5kJ/mol,则碳的燃烧热为110.5kJ/mol
D.同温同压下,已知两个放热反应:2A(g)+B(g)=2C(1) △H1;2A(l)+B(l)=2C(g) △H2,则△Hl<△H2
难度: 简单查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g)(△H>0),下列图象正确的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
在一密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,探讨温度对反应的影响,实验结果如下图所示(注:T1,T2均大于300 ℃),下列说法正确的是 ( )。
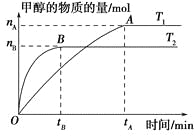
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=
mol·L-1·min-1
B.该反应在T1时的平衡常数比T2时的小
C.该反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时
增大
难度: 中等查看答案及解析
-
下列有关“电离平衡”的叙述正确的是( )
A.电离平衡是相对的、暂时的,外界条件改变时,平衡可能就会发生移动,最终电解质在溶液里的电离达到新的平衡
B.电解质达到电离平衡后,各种离子的浓度相等
C.电离平衡时,分子的浓度和离子的浓度相等
D.电离平衡时,由于分子和离子的浓度不再发生变化,所以说电离平衡是静态平衡
难度: 简单查看答案及解析
-
恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:
①固体NaOH;②固体KOH;③固体NaHSO4;④固体CH3COONa;⑤冰醋酸
其中一定可使c(CH3COO-)/c(Na+)比值增大的是 ( )
A. ①② B. ②⑤ C. ①⑤ D. ②④⑤
难度: 中等查看答案及解析
-
在2L的密闭容器中,发生3A(g)+2B(g)
4C(g)的反应,若最初加入A和B都是2mol,10s末,测得V(A)=0.06mol·(L·s)-1,则此时容器中B的物质的量是( )
A.0.8mol B.1.6mol C.1.2mol D.1.4mol
难度: 简单查看答案及解析
-
下列生产或实验事实引出的相应结论不正确的是( )
选项
事实
结论
A
其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短
当其他条件不变时,升高反应温度,化学反应速率加快
B
工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环
增大气液接触面积,使SO3的吸收速率增大
C
在容积可变的密闭容器中发生反应:2NH3(g)
N2H4(l)+H2(g),把容积的体积缩小一半
正反应速率加快,逆反应速率减慢
D
A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快
当其他条件不变时,催化剂可以改变化学反应速率
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列过程都与热量变化有关,其中表述不正确的是 ( )
A.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:CO(g)+1/2 O2(g)=CO2(g) ΔH=-283.0 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.醋酸的电离过程是吸热过程,升高温度,醋酸的Ka增大、pH减小
难度: 简单查看答案及解析
-
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
A.1mol/L氢氰酸溶液的pH约为3
B.HCN易溶于水
C.HCN溶液的导电性比盐酸溶液的弱
D.10mL1mol/LHCN恰好与10mL 1mol/L NaOH溶液完全反应
难度: 简单查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,可以通过出现浑浊的快慢来判断反应的快慢程度,下列各组实验中最先出现浑浊的是( )
实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
A
25
5
0.1
20
0.1
B
25
5
0.2
10
0.2
C
35
5
0.1
20
0.1
D
35
5
0.2
10
0.2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知如下两个热化学方程式:C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol ,2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ/mol。现有0.2mol炭粉和氢气组成的悬浮气体、固体混合物在氧气中完全燃烧,共放出63.53kJ热量。则炭粉与氢气的物质的量之比是( )
A.1:1 B.l:2 C.2:3 D.3:2
难度: 中等查看答案及解析