-
下列实验操作中,正确的是( )
A.萃取操作时,应选择有机萃取剂,且萃取剂密度必须比水大
B.用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中的NaCl溶液全部加热蒸干
C.蒸馏操作时,应使温度计水银球与蒸馏烧瓶的支管口相平
D.过滤时,可用玻璃棒不断搅拌,加快过滤速度
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.58.5g氯化钠中所含的离子数为NA
B.标准状况下,22.4L SO3含有的原子数为4NA
C.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L
D.1mol氯气与足量的NaOH溶液反应,转移电子数为NA
难度: 简单查看答案及解析
-
下列各组中的两种物质相互作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是( )
A.铁与氯气 B.钠与氧气 C.铁与稀硝酸 D.氢氧化钠溶液与二氧化碳
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.溶液和胶体最本质的区别是分散质粒子的大小
B.电解质与非电解质最本质的区别是在一定条件下能否电离
C.氧化还原反应与非氧化还原反应最本质的区别是反应中是否有电子的转移
D.强电解质与弱电解质最本质的区别是导电能力的强弱
难度: 简单查看答案及解析
-
下图所列的反应中,按照发生氧化反应,发生还原反应,既没发生氧化反应又没发生还原反应的顺序排列,正确的是( )
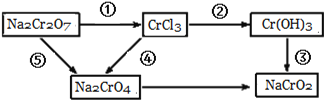
A.④;①;②③⑤
B.①;④;②③⑤
C.③;①;②④⑤
D.①;③;②④⑤
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.向溴水中通入SO2:SO2+2H2O+Br2=2H++SO42-+2HBr
B.碳酸氢钠溶液与足量的氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.漂白粉溶液在空气中失效:2ClO-+CO2+H2O=2HClO+CO32-
D.实验室制氢氧化铁胶体:Fe3++3H2O
Fe(OH)3↓+3H+
难度: 简单查看答案及解析
-
下列各组离子在溶液中能同时满足下列两个条件的是( )
(1)可以大量共存(2)加入氢氧化钠溶液后不产生沉淀
A.Na+、Ba2+、Cl-、SO42- B.K+、Na+、NO3-、CO32-
C.K+ 、NH4+、Fe3+、SO42- D.H+、Cl-、 CO32-、 NO3-
难度: 简单查看答案及解析
-
在标准状况下,若V L甲烷中含有的氢原子个数为n,则阿伏加德罗常数可表示为
A. Vn/22.4 B. 22.4n/V C. Vn/5.6 D. 5.6n/V
难度: 中等查看答案及解析
-
下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制氯水 ④氯气的CCl4溶液 ⑤盐酸 ⑥用盐酸酸化后的漂白粉溶液
A.①②③ B.①②③⑥ C.③⑥ D.②③⑥
难度: 简单查看答案及解析
-
下列对浓硫酸的叙述正确的是( )
A.常温下,浓硫酸与铁铝不反应,所以铁、铝制容器能盛装浓硫酸
B.浓硫酸具有吸水性,能使蔗糖炭化
C.浓硫酸和铜片加热既表现强酸性又表现强氧化性
D.浓硫酸和Na2SO3反应制取SO2时,浓硫酸表现出强氧化性
难度: 简单查看答案及解析
-
已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )
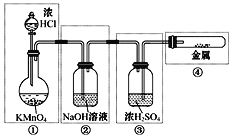
A.只有①和②处 B.只有②处 C.只有②和③处 D.只有②③④处
难度: 简单查看答案及解析
-
下列溶液中能够区别SO2和CO2气体的是( )
①石灰水 ②H2S溶液 ③酸性KMnO4溶液 ④氯水 ⑤品红溶液
A.①②③ B.②③④ C.②③④⑤ D.全部
难度: 简单查看答案及解析
-
将质量均为m g的O2、X、Y气体分别充入相同容积的密闭容器中,压强(p)与温度(T)的关系如图所示,则X、Y气体可能分别是( )
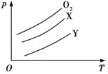
A.N2 CH4 B.CO2 SO2
C.Cl2 CO2 D.CH4 Cl2
难度: 中等查看答案及解析
-
右图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体。挤压滴管的胶头,下列与实验事实不相符的是( )

A.CO2(NaHCO3溶液)/无色喷泉 B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉 D.HCl(AgNO3溶液)/白色喷泉
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下不能实现的是( )
①Na
Na2O2
Na2CO3
②S
SO3
H2SO4
③Fe
Fe2O3
Fe2(SO4)3
④SiO2
Na2SiO3
H2SiO3
A.①②③ B.②③④ C.②③ D.①④
难度: 简单查看答案及解析
-
实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
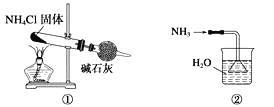
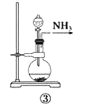
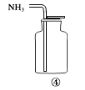
A.①是氨气发生装置 B.②是氨气吸收装置
C.③是氨气发生装置 D.④是氨气收集装置
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.灼烧白色粉末,火焰呈黄色,证明该粉末中有Na+、无K+
B.取少量溶液于试管中,加入浓NaOH溶液并加热, 用湿润的蓝色石蕊试纸检验,若变红则说明溶液中含NH4+
C.取少量溶液于试管中,加入硝酸酸化的Ba(NO3)2溶液,若产生白色沉淀,说明该溶液中含有SO42-
D.取少量溶液于试管中,加入硝酸酸化的硝酸银溶液,若产生白色沉淀,说明该溶液中含有Cl-
难度: 中等查看答案及解析
-
离子方程式BaCO3+2H+=CO2↑+H2O+Ba2+的H+不能代表的物质是( )
①HCl ②HNO3 ③CH3COOH ④NaHSO4 ⑤H2SO4
A.③ B.③④⑤ C.③⑤ D.⑤
难度: 简单查看答案及解析
-
将一定质量的铜与100 mL一定物质的量浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液中加入100mL 6 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度是( )
A.6mol/L B.10mol/L C.11mol/L D.12 mol/L
难度: 困难查看答案及解析