-
2018年世界环境日主题为“塑战速决”。下列做法不应该提倡的是( )
A. 使用布袋替代一次性塑料袋购物 B. 焚烧废旧塑料以防止“白色污染”
C. 用CO2合成聚碳酸酯可降解塑料 D. 用高炉喷吹技术综合利用废塑料
难度: 中等查看答案及解析
-
用化学用语表示C2H2+HCl
C2H3Cl(氯乙烯)中的相关微粒,其中正确的是( )
A. 中子数为7的碳原子:
C B. 氯乙烯的结构简式:CH2CHCl
C. 氯离子的结构示意图:
D. HCl的电子式:H+[
]-
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A. Al2O3的熔点很高,可用作耐火材料
B. NH3具有还原性,可用作制冷剂
C. SO2具有氧化性,可用于纸浆的漂白
D. 钠钾合金的密度小,可用作快中子反应堆的热交换剂
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 使pH试纸显蓝色的溶液中:Na+、Mg2+、ClO-、HSO3-
B. c(Fe3+)=0.1 mol·L-1的溶液中:K+、NH4+、SO42-、SCN-
C.
=0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
D. 0.1 mol·L-1的NaHCO3溶液中:NH4+、NO3-、Na+、SO42-
难度: 中等查看答案及解析
-
实验室用Ca与H2反应制取氢化钙(CaH2)。下列实验装置和原理不能达到实验目的的是( )
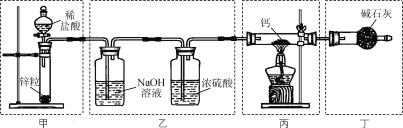
A. 装置甲制取H2 B. 装置乙净化干燥H2
C. 装置丙制取CaH2 D. 装置丁吸收尾气
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2===I2+2OH-
B. 过量的铁粉溶于稀硝酸:Fe+4H++NO3-===Fe3++NO↑+2H2O
C. 用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2O32-+5H2O===10H++2SO42-+8Cl-
D. 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32-
难度: 中等查看答案及解析
-
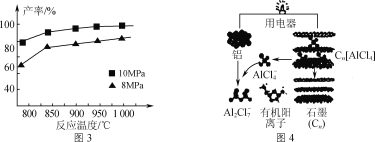
以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述不正确的是( )

A. 过程Ⅰ中的能量转化形式是太阳能→化学能
B. 过程Ⅰ中每消耗116 g Fe3O4转移2 mol电子
C. 过程Ⅱ的化学方程式为3FeO+H2O
Fe3O4+H2↑
D. 铁氧化合物循环制H2具有节约能源、产物易分离等优点
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的最外层电子数为内层电子数的3倍,X在短周期主族元素中金属性最强,W与Y属于同一主族。下列叙述正确的是( )
A. 原子半径:r(Z)>r(X)>r(W)
B. W的简单气态氢化物的热稳定性比Y的弱
C. 由W与X形成的一种化合物可作供氧剂
D. Y的最高价氧化物对应的水化物的酸性比Z的强
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能一步实现的是( )
A. S
SO3
H2SO4
B. NH3
NO2
HNO3
C. Cu2(OH)2CO3
CuCl2(aq)
Cu(s)
D. 饱和NaCl溶液
NaHCO3(s)
Na2CO3(s)
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 合成氨反应放热,采用低温可以提高氨的生成速率
B. 常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低
C. 反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0
D. 在一容积可变的密闭容器中反应2SO2(g)+O2(g)
2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,
的值增大
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀
X具有强氧化性
B
将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生
非金属性:Cl>Si
C
常温下,分别测定浓度均为0.1 mol·L-1 NaF和NaClO溶液的pH,后者的pH大
酸性:HF<HClO
D
卤代烃Y与NaOH水溶液共热后,加入足量稀硝酸,再滴入AgNO3溶液,产生白色沉淀
Y中含有氯原子
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是( )
A. 0.1 mol·L-1 NaHCO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)-c(CO32-)
B. 0.1 mol·L-1 NaHC2O4溶液呈酸性:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C. 20 mL 0.10 mol·L-1 CH3COONa溶液与10 mL 0.10 mol·L-1 HCl溶液混合得到的酸性溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
D. 向0.1mol·L-1 NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
难度: 中等查看答案及解析
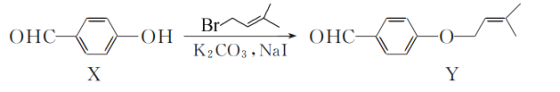




 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。__________