-
铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应1:Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g);ΔH1=akJ·mol-1
反应2:Al2O3(s)+3C(s)===2Al(l)+3CO(g);ΔH2=bkJ·mol-1
反应3:3AlCl(g)===2Al(l)+AlCl3(g);ΔH3
①反应3的ΔH3=_______kJ·mol-1。
②950℃时,铝土矿与足量的焦炭和Cl2反应可制得AlCl3。该反应的化学方程式是_______。
(2)在高温条件下进行反应:2Al(l)+AlCl3(g) 3AlCl(g)。
3AlCl(g)。
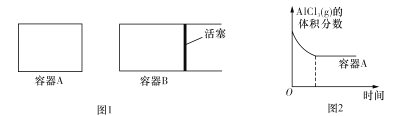
①向图1所示的等容积A、B密闭容器中加入足量的Al粉,再分别充入1 mol AlCl3(g),在相同的高温下进行反应。图2表示A容器内的AlCl3(g)体积分数随时间的变化图,在图2中画出B容器内AlCl3(g)体积分数随时间的变化曲线。__________
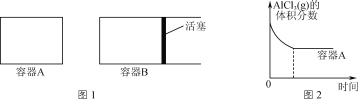
②1100℃时,向2 L密闭容器中通入3 mol AlCl(g),发生反应:3AlCl(g)=2Al(l)+AlCl3(g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K=________。
③加入3molAlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。此反应选择温度为900℃的原因是_______________。
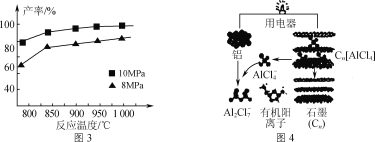
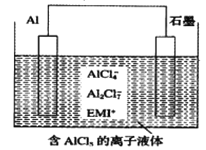
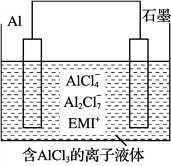
(3)用铝制作的快速放电铝离子二次电池的原理如图4所示。
①该电池充电时,阴极的电极反应式为_____。
②AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl4-和Al2Cl7-两种离子在电极上相互转化,其他离子不参与电极反应。NaCl的作用是_____。
-
铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应1:Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g);ΔH1=akJ·mol-1
反应2:Al2O3(s)+3C(s)===2Al(l)+3CO(g);ΔH2=bkJ·mol-1
反应3:3AlCl(g)===2Al(l)+AlCl3(g);ΔH3
①反应3的ΔH3=_______kJ·mol-1。
②950℃时,铝土矿与足量的焦炭和Cl2反应可制得AlCl3。该反应的化学方程式是_______。
(2)在高温条件下进行反应:2Al(l)+AlCl3(g) 3AlCl(g)。
3AlCl(g)。
①向图1所示的等容积A、B密闭容器中加入足量的Al粉,再分别充入1 mol AlCl3(g),在相同的高温下进行反应。图2表示A容器内的AlCl3(g)体积分数随时间的变化图,在图2中画出B容器内AlCl3(g)体积分数随时间的变化曲线。__________
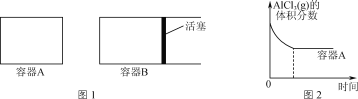
②1100℃时,向2 L密闭容器中通入3 mol AlCl(g),发生反应:3AlCl(g)=2Al(l)+AlCl3(g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K=________。
③加入3molAlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。此反应选择温度为900℃的原因是_______________。
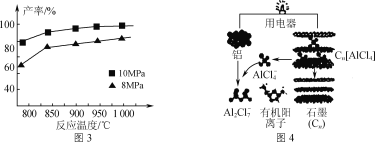
(3)用铝制作的快速放电铝离子二次电池的原理如图4所示。
①该电池充电时,阴极的电极反应式为_____。
②AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl4-和Al2Cl7-两种离子在电极上相互转化,其他离子不参与电极反应。NaCl的作用是_____。
-
铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应I: Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ΔH1=akJ·mol-1
反应Ⅱ:Al2O3(s)+3C(s) =2Al(g)+3CO(g) ΔH2=bkJ·mol-1
反应Ⅲ:3AlCl(g)=2Al(l)+AlCl3(g) ΔH3
①反应Ⅲ的△H3=____kJ/mol。
②950℃时,铝土矿(Al2O3)与足量的焦炭和C12反应可制得AlCl3。该反应的化学方程式是 _____________________________
(2)在高温条件下进行反应:2Al(l)+AlCl3 (g) 3AlCl(g)
3AlCl(g)
①向图1所示的起始容积相等的两个密闭容器A、B中加入足量的Al粉,再分别充入1molAICl3 (g),在相同的高温下进行反应。图2表示A容器内的AlC13(g)体积分数随时间的变化图,在图2中画出 B容器内AlCl3 (g)体积分数随时间的变化曲线____________。
②1 100℃时,向2L密闭容器中通入3mol AlCl(g),发生反应:3AlCl(g) 2Al(l)+AlCl3 (g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K= ___。在反应达到平衡后,再加入1molAlCl(g),重新达到平衡时AlCl(g)的平衡转化率将 ___(填“增大”“减小”或“不变”)。
2Al(l)+AlCl3 (g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K= ___。在反应达到平衡后,再加入1molAlCl(g),重新达到平衡时AlCl(g)的平衡转化率将 ___(填“增大”“减小”或“不变”)。
③加入3 mol AlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。则此反应选择温度为 _____________________
(3)铝可以用来制作快速放电铝离子二次电池,该电池以金属铝和石墨为电极,用AlCl4-、Al2Cl2-和有机阳离子组成电解质溶液,其工作原理如图4所示。
①该电池放电时,AlCl4-向 ___(填“铝电极”或“石墨电极”)方向移动。
②该电池充电时,阴极的电极反应式为____。
-
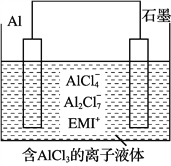
高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如下图所示(EMI+为有机阳离子)。
①Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) △H1=a kJ·mol-1
②3AlCl(g)===2A1(1)+AlCl3(g) △H2=b kJ·mol-1
③Al2O3(s)+3C(s)===2A1(1)+3CO(g) △H3
下列说法正确的是
A. 该电池放电时的负极反应方程式为A1-3e-+7AlCl4-===4A12C17-
B. ΔH2<0
C. 该电池充电时石墨电极与电源负极相连
D. A12O3(s)+3C(s)===2A1(1)+3CO(g) ΔH3=(a-b) kJ·mol-1
-
高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如右图所示(EMI+为有机阳离子)。
①Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH1=a kJ·mol-1
②3AlCl(g)===2Al(l)+AlCl3(g) ΔH2=b kJ·mol-1
③Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3
下列说法正确的是( )
A. ΔH3<0
B. Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3=(a-b) kJ·mol-1
C. 该电池充电时石墨电极与电源负极相连
D. 该电池放电时的负极反应方程式为Al-3e-+7AlCl===4Al2Cl
-
高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如右图所示(EMI+为有机阳离子)。
①Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH1=a kJ·mol-1
②3AlCl(g)===2Al(l)+AlCl3(g) ΔH2=b kJ·mol-1
③Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3
下列说法正确的是( )
A. ΔH3<0
B. Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3=(a-b) kJ·mol-1
C. 该电池充电时石墨电极与电源负极相连
D. 该电池放电时的负极反应方程式为Al-3e-+7AlCl===4Al2Cl
-
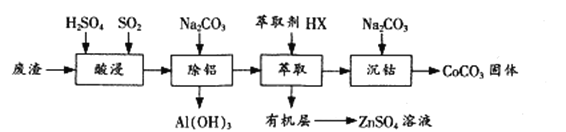
过渡金属催化的反应已成为重要的合成工具,贵金属成本高,会对环境造成的不利影响。因此研究成本低廉的含锰、铁、钴、镍、铜等催化剂应用成为热点。以下是以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Co2+ | 7.6 | 9.4 |
| Al3+ | 3.0 | 5.0 |
| Zn2+ | 5.4 | 8.0 |
回答下列问题:
(1)“酸浸”时通入SO2的目的是 ____________,反应的离子方程式为______________。
(2)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 __________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 __________________。
(3)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 ____________。
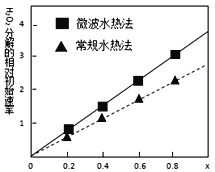
(4)用得到的CoCO3等为原料采用微波水热法和常规水热法可以制得两种CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。如图是两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:____________法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是____________ 。
(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中 =___________。[已知Ksp(CoC2O4)=6.3×10-8 Ksp (CoCO3) =1.4×10- 13]
=___________。[已知Ksp(CoC2O4)=6.3×10-8 Ksp (CoCO3) =1.4×10- 13]
-
下列说法正确的是
A. 高纯度的SiO2是制备光导纤维、太阳能电池板的主要材料
B. NO2有氧化性,可以损害多种织物和尼龙制品
C. Al2O3熔点高,一般采用电解熔融的AlCl3制备金属铝
D. 利用Na2CO3可与盐酸反应的原理,治疗胃酸过多
-
下列说法正确的是
A. 高纯度的SiO2是制备光导纤维、太阳能电池板的主要材料
B. NO2有氧化性,可以损害多种织物和尼龙制品
C. Al2O3熔点高,一般采用电解熔融的AlCl3制备金属铝
D. 利用Na2CO3可与盐酸反应的原理,治疗胃酸过多
-
AlN新型材料应用前景广泛,其制备与性质研究成为热点。
相关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
| Al | 660 | 2467 | >800 | AlN:>2000 (>1400升华) AlCl3:(>181升华) |
| Mg | 649 | 1090 | >300 | Mg3N2:>800 |
(1)AlN的制备。
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是____________________。
Ⅱ.上述反应适宜的温度范围是______℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:__________________、_________和2Al + N2  2AlN。
2AlN。
③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) ⇌ 4Al(g) + 3O2(g) ∆H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) ∆H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) ∆H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:______________________________________。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。
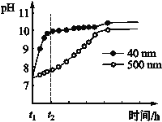
① AlN粉末水解的化学方程式是____________________________________。
② 解释t1-t2时间内两条曲线差异的可能原因:_______________________________。
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是________________________________。
3AlCl(g)。











