-
下列比较错误的是
A. 原子半径:N>O>F
B. 酸性强弱:HNO3>H3PO4>H2SO4
C. 碱性强弱:KOH >NaOH>Mg(OH)2
D. 氢化物的稳定性:HF>HCl>H2S
难度: 中等查看答案及解析
-
某元素的原子核外有三个电子层,M层的电子数是L层电子数的1/2,则该元素的原子是
A. Li B. Si C. Al D. K
难度: 简单查看答案及解析
-
下列气体中既可用浓硫酸干燥,又可用固体氢氧化钠干燥的是
A. NH3 B. H2 C. Cl2 D. SO2
难度: 中等查看答案及解析
-
下列化学用语错误的是( )
A. H2O2的电子式为H:O::O:H B. 次氯酸的结构式H-O-Cl
C. 氯化氨的电子式
D. 氟离子的结构示意图
难度: 简单查看答案及解析
-
下列分子中,所有原子的最外层均满足8电子稳定结构的是( )
A. PCl5 B. N2 C. BF3 D. H2O
难度: 简单查看答案及解析
-
右图是元素周期表的一部分,下列关系判断正确的是
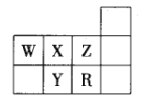
A. 原子半径:Y > X > W
B. 氢化物的沸点:W > X > Y
C. 氢化物的稳定性:R > Y > X
D. 简单阴离子的还原性:Y > R > Z
难度: 中等查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.
与
得电子能力相同
B. 核外电子排布相同的微粒化学性质也相同
C. Cl-、S2-、Ca2+、K+半径逐渐减小
D. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
难度: 简单查看答案及解析
-
下列变化中,不需要破坏化学键的是( )
A. 氯化氢溶于水 B. 氯化钠溶于水 C. 干冰的升华 D. 氯化钠熔化
难度: 中等查看答案及解析
-
镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述不正确的是( )
A. 在化合物中呈+2价 B. 单质能与水反应放出氢气
C. 镭比钙的金属性弱 D. 碳酸镭难溶于水
难度: 简单查看答案及解析
-
下列化合物中,既含有极性键又含有非极性键的是( )
A. Na2O2 B. H2O2 C. CH4 D. NH4Cl
难度: 简单查看答案及解析
-
X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为
A. X>Z>Y>M B. X>Y>Z>M C. M>Z>X>Y D. X>Z>M>Y
难度: 中等查看答案及解析
-
下列反应中,属于吸热反应的是
A. Na与H2O反应 B. H2在Cl2中燃烧
C. NaOH溶液与盐酸反应 D. Ba(OH)2·8H2O与NH4Cl反应
难度: 中等查看答案及解析
-
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
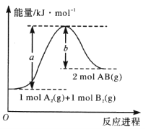
A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ • mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
难度: 简单查看答案及解析
-
锌锰干电池放电时总反应方程式为:Zn(s)+2MnO2+2NH4+Zn2++Mn2O3(s)+2NH3↑+H2O, 此电池放电时正极(碳棒)上发生反应的物质是
A.Zn B.碳 C.MnO2和NH4+ D.Zn2+和NH3
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 同温同压下,H2 (g)+Cl2(g)
2HCl(g)在光照和点燃条件下的ΔH相同
B. 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
C. 已知:①2H2(g) +O2(g)
2H2O(g) ΔH=-a kJ·mol-1,②2H2(g)+O2 (g)
2H2O(l) ΔH=-b kJ·mol-1,则a>b
D. 已知:①C(s,石墨)+O2 (g)
CO2(g) ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)
CO2 (g) ΔH=-395.0 kJ·mol-1,则C(s,石墨)
C(s,金刚石) ΔH= -1.5 kJ·mol-1
难度: 中等查看答案及解析
-
如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化) ( )
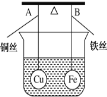
A. 杠杆为导体和绝缘体时,均为A端高B端低
B. 杠杆为导体和绝缘体时,均为A端低B端高
C. 当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D. 当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
难度: 中等查看答案及解析