-
下列各组中两种微粒所含电子数不相等的是
A. H3O+和OH- B. CO和N2 C. HNO2和NO2- D. CH3+和NH4+
难度: 简单查看答案及解析
-
我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指
A. 氨水 B. 硝酸 C. 醋 D. 卤水
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A. Al2O3熔点高,可用作耐高温材料
B. SO2具有氧化性,可用于漂白纸浆
C. SiO2硬度大,可用于制造光导纤维
D. NH3易溶于水,可用作制冷剂
难度: 简单查看答案及解析
-
下列各组中顺序的排列不正确的是( )
A. 酸性:HClO4>H2SO4>H3PO4>H2SiO3
B. 稳定性:HF>H2O>H2S
C. 碱性:KOH>NaOH>Mg(OH)2
D. 熔沸点:HI>HBr>HCl>HF
难度: 中等查看答案及解析
-
某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A. HX B. H2X C. XH3 D. XH4
难度: 中等查看答案及解析
-
江苏省已开始大力实施“清水蓝天”工程。下列不利于“清水蓝天”工程实施的是( )
A. 催化处理汽车尾气,减轻氮氧化物污染和光化学烟雾
B. 加强城市生活污水脱氮除磷处理,遏制水体富营养化
C. 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用
D. 将废旧电池深埋,防止污染环境
难度: 简单查看答案及解析
-
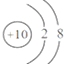
已知R原子有b个中子,R2+核外有a个电子.表示R原子符号正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
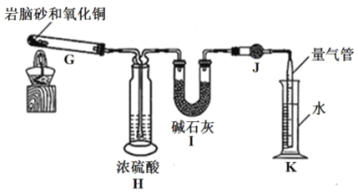
据报道,科学家新合成了一种抗癌、治癌的药物,其化学式可表示为10B20.下列叙述正确的是( )
A. 10B20为硼元素的一种原子
B. 10B20为硼元素的一种单质
C. 10B20的中子数比核外电子数多
D. 10B20的原子核外电子排布为
难度: 中等查看答案及解析
-
下列分子中,所有原子都满足最外层为8电子结构的是( )
A. BF3 B. PCl5 C. NCl3 D. CH4
难度: 中等查看答案及解析
-
关于化学反应与能量的说法正确的是( )
A. 中和反应是吸热反应
B. 氧化钙溶于水属于放热反应
C. 凡经加热而发生的化学反应都是吸热反应
D. 反应物总能量与生成物总能量一定相等
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. NaHSO4在熔融状态下电离与在水中电离时,破坏的化学键完全相同
B. H2O比H2S分子稳定,是因为H2O分子间能形成氢键
C. NaCl和HCl气化时,克服的作用力不相同,故沸点不同
D. 碘沸点低、易升华,是因为分子中的 I﹣I键能较小
难度: 中等查看答案及解析
-
通常人们把拆开1mol化学键吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热.下列是一些化学键的键能.
化学键
C﹣H
C﹣F
H﹣F
F﹣F
键能/(kJ•mol﹣1)
414
489
565
155
根据键能数据估算反应CH4+4F2═CF4+4HF每消耗1molCH4的热效应( )
A. 放热1940kJ B. 吸热1940kJ C. 放热485kJ D. 吸热485kJ
难度: 简单查看答案及解析
-
下列反应中,生成物总能量高于反应物总能量的是( )
A. 碳酸钙受热分解 B. 乙醇燃烧
C. 铝粉与稀盐酸反应 D. 氧化钙溶于水
难度: 简单查看答案及解析
-
关于化学键的叙述中,正确的是( )
A. HCl电离产生H+和Cl﹣,可判断HCl分子中存在离子键
B. 阴、阳离子间通过静电引力所形成的化学键是离子键
C. 化学变化过程,一定会破坏旧的化学键,同时形成新的化学键
D. 不同元素组成的多原子分子中的化学键一定全是极性键
难度: 中等查看答案及解析
-
已知短周期主族元素的离子 aA2+、bB+、cC3﹣、dD﹣都具有相同的电子层结构,下列叙述正确的是( )
A. 离子的还原性:C3﹣<D﹣
B. 原子序数 d>c>b>a
C. 离子半径 C>D>B>A
D. 单质的还原性 A>B>D>C
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价见表:
元素
甲
乙
丙
丁
戊
原子半径
0.16
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6、﹣2
+2
﹣2
下列叙述中正确的是( )
A. 乙与戊形成的化合物可与氢氧化钠溶液反应
B. 常温下,乙单质能与丙最高价氧化物对应水化物的浓溶液发生剧烈反应
C. 形状、大小完全相同的甲、丁的单质与同浓度稀盐酸反应速率:甲<丁
D. 丙单质在戊单质中燃烧,生成一种有刺激性气味的气体,该物质中丙为+6价
难度: 中等查看答案及解析
-
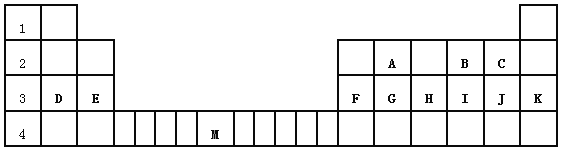
短周期元素X、Y、Z、W 在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍。下列说法不正确的是( )
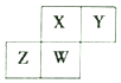
A. 原子半径:Z>W>X>Y
B. 最简单气态氢化物的热稳定性:X>Y>W>Z
C. 最高价氧化物对应水化物的酸性;X>W>Z
D. Y 与X、Y 与Z形成的化合物的化学键类型相同
难度: 中等查看答案及解析
-
固体NH5(也可写为:NH4H)属离子化合物,它与水反应的方程式为:NH5+H2O═NH3•H2O+H2↑,它也能跟乙醇、乙酸、盐酸等发生类似的反应,并都产生氢气.下列有关NH5叙述正确的是( )
A. 1mol NH5中含有3NA个N﹣H键
B. NH5中N元素的化合价为﹣5价
C. 1mol NH5与水反应时,转移电子为NA
D. 与乙酸反应时,NH5被还原
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A. 铜跟浓HNO3反应:3Cu+8H++2NO3﹣═3Cu2++2NO↑+4H2O
B. 向氯化铝溶液中加入过量氨水:Al3++3OH﹣═AlO2﹣+2H2O
C. 向水中通入NO2:3NO2+H2O═2H++2NO3﹣+NO
D. NH4Cl溶液和AgNO3溶液混合:NH4Cl+Ag +═AgCl↓+NH4+
难度: 中等查看答案及解析
-
对于可能存在的第119号元素,有人称之为“类钫”。根据周期表结构及元素性质变化趋势,判断下列有关“类钫”的预测说法不正确的是( )
A. “类钫”元素位于元素周期表的第八周期,在化合物中显+1价
B. “类钫”元素的非金属性极强,其最高价氧化物对应的水化物为强酸
C. “类钫”单质遇水剧烈反应,可能发生爆炸
D. “类钫”单质的密度大于钫单质,且大于1g/cm3
难度: 中等查看答案及解析
-
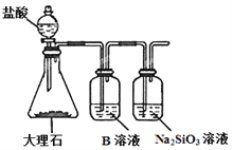
根据SO2通入不同溶液中的实验现象,所得结论正确的是( )
实验
现象
结论
A
酸性KMnO4溶液
紫色溶液褪色
说明SO2有漂白性
B
H2S溶液
产生黄色沉淀
黄色沉淀为S,说明SO2有氧化性
C
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3>H2SiO3
非金属性:S>Si
D
含HCl、BaCl2的FeCl3溶液
产生白色沉淀
白色沉淀为BaSO3,说明SO2有还原性
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
如图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是( )
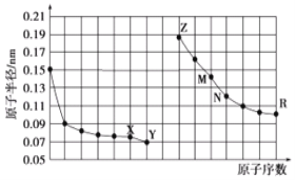
A. M的最高价氧化物对应水化物能分别与Z、R的最高价氧化物对应水化物反应
B. Y的单质能从含R简单离子的水溶液中置换出R单质
C. X、N两种元素组成的化合物熔点很低
D. 简单离子的半径:Z<X<Y
难度: 中等查看答案及解析
-
下列实验现象预测正确的是( )
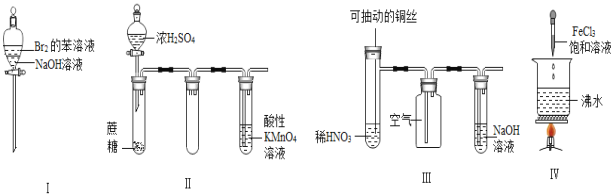
A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:滴入FeCl3后,可形成带电的胶体,该分散系导电能力增强
难度: 中等查看答案及解析
-
如图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹,下列与实验事实相符的是( )
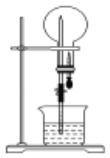
A. NH3(H2O含紫色石蕊试液),红色喷泉
B. SO2(NaOH溶液),无色喷泉
C. HCl(H2O含紫色石蕊试液),蓝色喷泉
D. NO(NaOH溶液),无色喷泉
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列判断正确的是( )
A. 0.1 mol Na2O2含有的离子总数为0.4NA
B. 常温常压下,18g 2H2O 所含的中子数为9NA
C. 常温常压下,17g氨气中含有非极性共价键为3NA
D. 标准状况下,1mol SO3的体积为22.4 L
难度: 中等查看答案及解析