-
根据所给信息和标志,判断下列说法错误的是
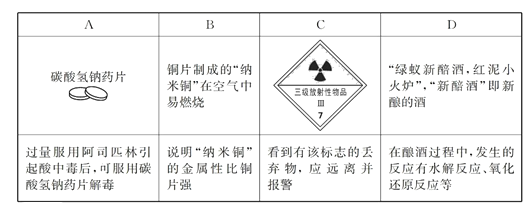
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值。下列叙述正确的是
A. Cu与浓硝酸反应生成4.6gNO2和N2O4混合气体时,转移电子数为0.1NA
B. 标准状況下,2.24L已烷中共价键的数目为1.9NA
C. 在0.1mol/L的Na2CO3溶液中,阴离子总数一定大于0.1NA
D. 34gH2O2中含有的阴离子数为NA
难度: 中等查看答案及解析
-
下列实验现象和结论相对应且正确的是
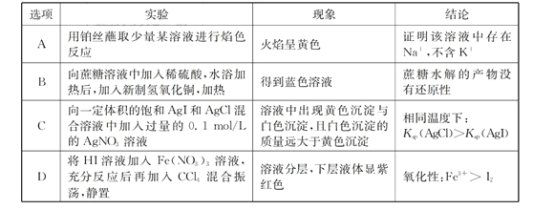
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一种芳纶纤的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图所示:
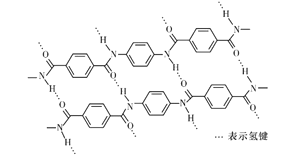
下列关于该高分子的说法不正确的是
A. 芳纶纤维可用作航天、航空、国防等高科技领域的重要基础材料
B. 完全水解产物的单个分子中,含有官能团一COOH或一NH2
C. 氢键对该高分子的性能有影响
D. 结构简式为
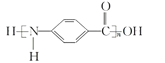
难度: 中等查看答案及解析
-
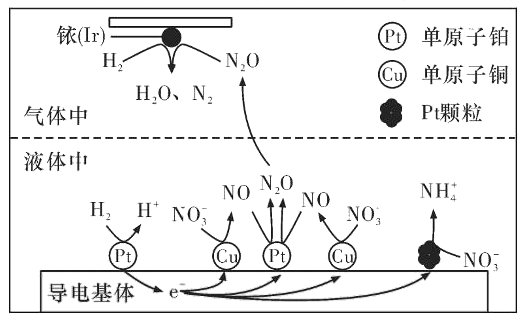
科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续,合成其原理如图所示。下列说法不正确的是
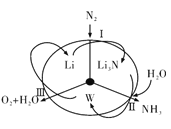
A. 过程I得到的Li3N的电子式为
B. 过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑
C. 过程Ⅲ涉及的阳极反应为4OH--4e-=O2↑+2H2O
D. 过程I、Ⅱ、Ⅲ均为氧化还原反应
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是
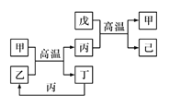
A. W的原子序数是Z的两倍,金属性强于Z
B. W元素在周期表中的位置是第四周期VIII族
C. 丙属于两性氧化物
D. 等物质的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量一定相等
难度: 中等查看答案及解析
-
分别向体积均为100mL、浓度均为1mol/L的NaClO、NaOH、CH3COONa的三种溶液中通入CO2,测得各溶液中n(HCO3-)的变化如下图所示:
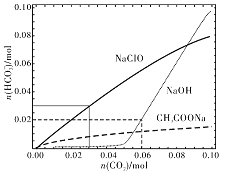
下列分析正确的是
A. CO2通入NaClO溶液的反应:2ClO-+CO2+H2O=CO32-+2HClO
B. CO2通入CH3COONa溶液的反应:CO2+H2O+CH3COO-=HCO3-+CH3COOH
C. 通入n(CO2)=0.06mol时,NaOH溶液中的反应:2OH-+CO2=CO32-+H2O
D. 通入n(CO2)=0.03mol时,三种溶液中:n(HCO3-)+n(CO32-)+n(H2CO3)=0.03mol
难度: 中等查看答案及解析
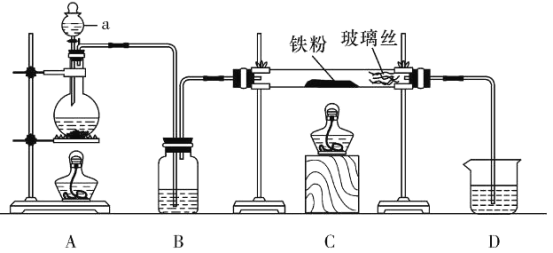

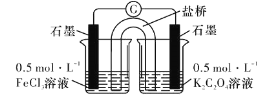
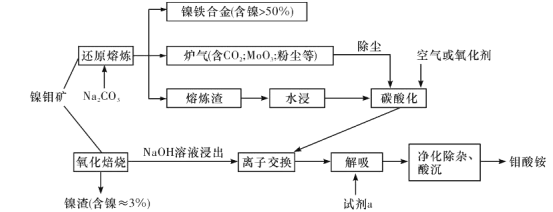
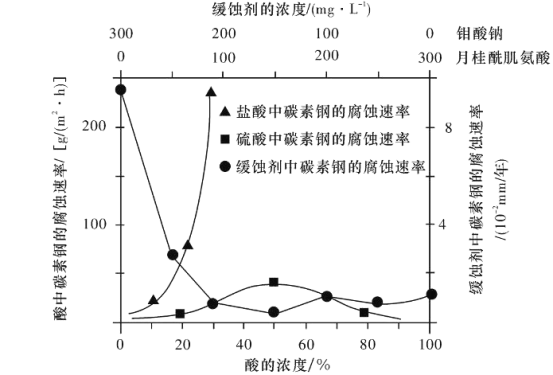

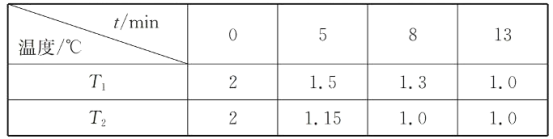
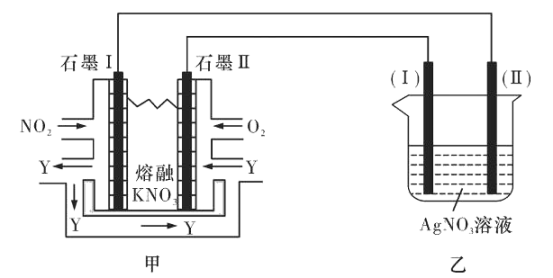 请回答下列问题:
请回答下列问题: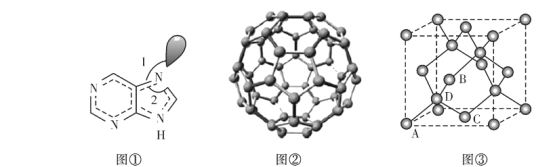
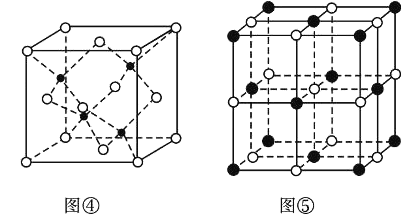
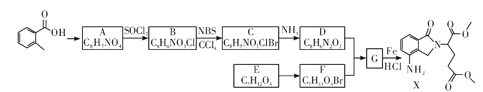
 ;
; ;
; 。
。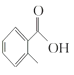 的名称是__________
的名称是__________