-
1956年,杨振宁和李政道提出在弱相互作用中宇称不守恒,并由吴健雄用
放射源进行了实验验证。次年,杨振宁、李政道两人因此获得诺贝尔物理奖。下列关于该Co的叙述中,错误的是
A. 质量数是27 B. 电子数是27 C. 质子数是27 D. 中子数是33
难度: 中等查看答案及解析
-
下列说法,正确的是
A. 13C与C60互为同素异形体
B. 中国天眼FAST用到的碳化硅是一种新型的无机非金属材料
C. 玻璃钢和钢化玻璃的成分相同
D. 硅的化学性质不活泼,常温下不与任何物质反应
难度: 中等查看答案及解析
-
化学反应前后肯定没有变化的是
①原子数 ②分子数 ③元素种类 ④物质的总质量 ⑤物质的种类 ⑥共价键数
A. ②④⑥ B. ①③④ C. ①③⑤ D. ①③⑥
难度: 中等查看答案及解析
-
下列有关化学用语的表示方法中正确的是
A. 氯元素的原子结构示意图:
B. 原子核内有8个中子的氧原子:
C. N2的结构式:N≡N
D. 二氧化碳的电子式:
难度: 中等查看答案及解析
-
下列有关物质的说法不正确的是
A. 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件。高温时可用金属钠还原相应的氯化物来制取金属钛
B. 水泥、玻璃、砂锅、水晶饰物都是硅酸盐制品
C. 氯化铁有氧化性,可用于腐蚀铜制线路板
D. 氧化铝可用作耐高温材料;晶体硅可用于制作半导体材料
难度: 中等查看答案及解析
-
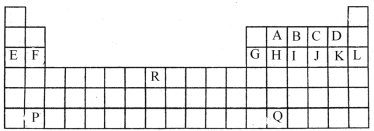
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
A. 同一元素不可能既表现金属性,又表现非金属性
B. 短周期元素形成离子后,最外层电子都达到8电子稳定结构
C. 第三周期元素的最高正化合价等于它所处的主族序数
D. VIIA族元素均能与水反应:X2 + H2O == HX + HXO (X为F、Cl、Br、I)
难度: 中等查看答案及解析
-
已知最外层电子数相同的原子具有相似的化学性质。在下列四种原子中,与硅原子化学性质相似的是
A.
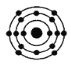 B.
B. 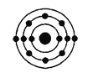 C.
C.  D.
D. 
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 在任何分子中都含有化学键
B. 形成离子键的阴阳离子间只存在静电吸引力
C. CO2、PCl3分子中所有原子都满足最外层8电子稳定结构
D. D2O与H2O所含电子总数不相等
难度: 中等查看答案及解析
-
在密闭系统中有反应C(s)+CO2(g)
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量
A. ①②③④ B. ①②④ C. ①②③ D. ①②③④⑤
难度: 中等查看答案及解析
-
下列相关的叙述正确的是
A. 生成物的总能量一定低于反应物的总能量
B. 吸热反应一定需要加热才能发生
C. 金属元素与非金属元素形成的化合物一定是离子化合物
D. 在元素周期表中位于金属元素和非金属元素交界处最容易找到半导体材料
难度: 中等查看答案及解析
-
2015年12月30日,IUPAC与IUPAP组建的联合工作组确认人工合成了113号、115号、117号和118号4个新元素。2016年11月30日,IUPAC正式公布113号元素名为nihonium,符号为Nh;115号元素名为moscovium,符号为Mc;117号元素名为tennessine,符号为Ts;118号元素名为oganesson,元素符号为Og。下列有关叙述中错误的是
A. 113号元素是金属 B. 115号元素是非金属
C. Og质子数是118 D. 117号元素在第七周期
难度: 中等查看答案及解析
-
下列关于SiO2和CO2的叙述中不正确的是
A. 都是共价化合物
B. SiO2可用于制造光导纤维,干冰可用于人工降雨
C. 都是酸性氧化物,都能与强碱溶液反应
D. 都能溶于水且与水反应生成相应的酸
难度: 中等查看答案及解析
-
已知SO2和O2反应生成2molSO3时,放出的热量为QKJ,在1L的密闭容器中进行反应 2SO2(g)+O2(g)
2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是
A. 反应达到平衡时放出的热量为0.1QKJ
B. 某时刻,SO3的物质的量为0.28 mol,则SO2的转化率为40%
C. 某时刻,SO2、O2、SO3的物质的量分别为0.3mol、0.15mol、0.15mol
D. 某时刻,SO3的浓度可能为0.4mol-1·L-1
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. AlCl3溶液中加入过量NaOH溶液:Al3++3OH-===Al(OH)3↓
B. 用NaOH溶液溶解Al2O3:Al2O3+6OH-===2[Al(OH)4]-+H2O
C. 铝片碱洗时常有气泡:2Al+4OH-===2[Al(OH)4] -+H2↑
D. 少量二氧化碳通入“水玻璃”中:CO2 +SiO32-+H2O=CO32-+H2SiO3↓
难度: 中等查看答案及解析
-
某元素的一种同位素X的原子质量数为A,含N个中子,它与2H原子组成2HX分子。在ag2HX中所含质子数是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
在2L的密闭容器中,投入0.2mol N2和0.6 mol H2 ,发生可逆反应N2(g)+3H2(g)
2NH3(g),2min后,生成0.04molNH3,下列说法中正确的是
A. 2min内H2的反应速率为0.01mol·L-1·min-1
B. 若2min后,往容器中通入0.2mol的氩气,则生成NH3的反应速率加快
C. 若混合气体的密度不再改变,则反应达到平衡状态
D. 若单位时间内有3 mol H-H键断裂,同时就有6 mol N-H键断裂,则反应达到平衡状态
难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数的数值,下列叙述中错误的是
A. 标准状况下,11.2LCH4中含有2NA个共价键
B. 7.8g Na2O2与过量CO2反应,转移电子数为0.1NA
C. 5.5g超重水(T2O)中含有的中子数为3NA
D. 在熔融状态下,1mol NaHSO4完全电离出的离子总数为3NA
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中均能大量共存的是
A. 在K2CO3溶液中:Na+、H+、Cl-、Br-
B. 使酚酞变红的溶液:NH4+、CH3COO-、SO42-、Mg2+
C. 无色溶液:OH-、K+、[Al(OH)4]-、Ba2+
D. 加入金属铝会产生氢气的溶液:K+、NO3-、Cl-、H+
难度: 中等查看答案及解析
-
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是其电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法不正确的是
A. Y元素的最高价氧化物的水化物化学式为HYO4
B. 它们形成的简单离子半径:X>W
C. X、Z两种元素的气态氢化物稳定性:X>Z
D. X与W形成的化合物中阴、阳离子个数比为1:1或1:2
难度: 中等查看答案及解析
-
现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为
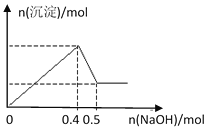
A. 1:3 B. 1:6
C. 2:3 D. 3:2
难度: 中等查看答案及解析