-
下列说法中错误的是( )
A. 原子及其离子的核外电子层数等于该元素所在的周期数
B. 元素周期表中从ⅢB族到ⅡB族10个纵列的元素都是金属元素
C. 除氦外的稀有气体原子的最外层电子数都是8
D. 同一元素的各种同位素化学性质几乎完全相同
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 16g18O2的中子数为10NA B. 1.9g1H37Cl的电子数为0.9NA
C. 7.0g35Cl2的体积为2.24L D. 35Cl2的摩尔质量为70g
难度: 中等查看答案及解析
-
下列有关碱金属元素和卤素的说法中,错误的是( )
A. 溴单质与H2的反应比碘单质与H2的反应更剧烈
B. 碱金属元素中,锂原子还原性最弱;卤素中,氟原子氧化性最强
C. 钾与水的反应比钠与水的反应更剧烈
D. 随核电荷数的增加,碱金属元素和卤素的单质熔沸点都逐渐降低
难度: 简单查看答案及解析
-
元素的性质随着原子序数的递增呈现周期性的变化的根本原因是( )
A. 元素相对原子质量的递增,量变引起质变
B. 元素的金属性和非金属性呈周期性变化
C. 元素原子核外电子排布呈周期性变化
D. 元素化合价呈周期性变化
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 铊与铝同主族,氧化铝是两性氧化物,所以氧化铊也是两性氧化物
B. 第三周期简单离子的半径从左到右依次减小
C. 用电子式表示HCl的形成过程
D. 在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料
难度: 中等查看答案及解析
-
下列说法正确的是( )
①离子化合物一定含离子键,也可能含共价键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥离子化合物在熔融状态下能导电
A. ①③⑤ B. ②④⑥ C. ②③④ D. ①③⑥
难度: 中等查看答案及解析
-
下列递变规律正确的是( )
A. HClO4、H2SO4、H3PO4的酸性依次增强
B. 钠、镁、铝的还原性依次减弱
C. HCl、HBr、HI的稳定性依次增强
D. 由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. 周期表中第15列元素的最高价氧化物对应水化物的化学式均为H3RO4
B. O22-与 S2-具有相同的质子数和电子数
C. 所有主族元素的最高正价均与其族序数相等
D. 若R2-和M+ 的电子层结构相同,则原子序数:R>M
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 干冰升华时,二氧化碳分子中的共价键不发生断裂
B. C(石墨)=C(金刚石),反应中既没有电子的得失也没有能量的变化
C. 凡经加热而发生的化学反应都是吸热反应
D. 燃料燃烧时只是将化学能转化为热能
难度: 中等查看答案及解析
-
下列所述变化中,前者是吸热反应,后者是放热反应的是( )
A. Ba(OH)2·8H2O与NH4Cl的反应;氢氧化钠溶于水
B. 点燃的镁条在二氧化碳中继续燃烧;碳酸氢钠分解
C. 灼热的碳与二氧化碳的反应;氢气在氯气中燃烧
D. 酸碱中和;焦炭与高温水蒸气反应
难度: 简单查看答案及解析
-
下列有关电池的说法不正确的是( )
A. 铜锌原电池工作时,电子在电解液中从锌电极流向铜电极
B. 锌锰干电池中,锌电极是负极
C. 氢氧燃料电池可把化学能转化为电能
D. 手机上用的锂离子电池属于二次电池
难度: 简单查看答案及解析
-
锌空气电池具有蓄电量大、充电循环次数多等优点(Zn与Al的化学性质相似)。下列有关说法错误的是( )
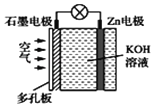
A. 电池放电时Zn电极逐渐溶解 B. 电池放电时化学能转化为电能
C. 电子由石墨经导线流向Zn片 D. 石墨为正极
难度: 中等查看答案及解析
-
下列关于化学反应速率的说法正确的是( )
A. 0.1 mol·L-1盐酸和硫酸分别与2 mol·L-1氨水反应速率相同
B. 0.1 mol·L-1盐酸和硝酸与相同形状和大小的大理石反应的速率相同
C. 0.8 mol·L-1·s-1的含义是时间为1s时,某物质的浓度是0.8 mol·L-1
D. 对于任何化学反应来说,反应速率越大,反应现象就越明显
难度: 简单查看答案及解析
-
在体积固定的密闭容器中,进行的可逆反应为A(固) +3B(气)
3C(气)。下列叙述中表明可逆反应一定达到平衡状态的是( )
①C的生成与分解速率相等 ②单位时间内生成amolA和3amolB
③B的浓度不再变化 ④混合气体总的物质的量不再发生变化
⑤A、B、C的物质的量之比为1:3:3 ⑥混合气体的密度不再变化
A. ①②③ B. ①③④⑥ C. ①③⑥ D. ①③④⑤
难度: 中等查看答案及解析
-
在4L密闭容器中充入6molA气体和5molB气体,一定条件下发生反应:3A(g)+B(g)
2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是
A. B的转化率为20%
B. 平衡时A的浓度为1.50mol/L
C. x=1
D. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期主族元素,原子序数依次增加。W原子最外层电子数是其所在周期数的2倍;Y+和X2-的电子层结构相同;Z的原子序数等于W和Y的核外电子数之和。下列说法正确的是( )
A. Z的氢化物的酸性比WX2的水化物的强,说明Z的非金属性比W的强
B. 离子半径大小:Z>Y>X
C. 工业上用MnO2和Z的氢化物的浓溶液在加热的条件下制取Z的单质
D. 能形成WX2这种共价化合物
难度: 中等查看答案及解析